稀土是一種重要的戰略資源。氟碳鈰礦主要化學成分為CeFCO3,它是提取鈰等稀土元素的重要礦物原料。氟碳鈰礦的冶煉工藝流程如圖。
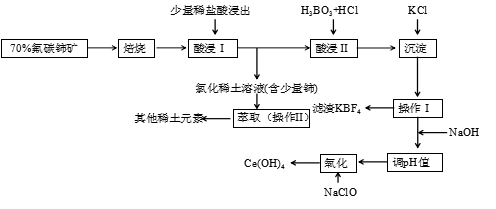
已知:
ⅰ.鈰的常見化合價為+3、+4。焙燒后鈰元素轉化成CeO2和CeF4。四價鈰不易進入溶液,而三價稀土元素易進入溶液。
ⅱ.酸浸Ⅱ中發生反應:9CeO3+3CeF4+45HCl+3H3BO3═Ce (BF4)3↓+11CeCl3+6Cl↑+27H2O
請回答下列問題:
(1)①焙燒氟碳鈰礦的目的是 將鈰氧化為四價便于與其他稀土元素分離將鈰氧化為四價便于與其他稀土元素分離。
②焙燒后產生的CeO2是氣體尾氣凈化催化劑的關鍵成分,它能在還原氣氛中供氧,在氧化氣氛中耗氧。在尾氣消除過程中發生著CeO2?CeO2(1-x)+xO2↑的循環。寫出CeO2消除CO尾氣的化學方程式:2xCO+CeO2=CeO2(1-x)+2xCO22xCO+CeO2=CeO2(1-x)+2xCO2。
(2)在酸浸I中用鹽酸浸出時,有少量鈰進入濾液,且產生黃綠色氣體。少量鈰進入稀土溶液發生反應的離子方程式是 8H++2Cl-+2CeO2=2Ce3++Cl2↑+4H2O8H++2Cl-+2CeO2=2Ce3++Cl2↑+4H2O。
(3)操作Ⅰ的名稱為 過濾過濾,在實驗室中進行操作Ⅱ時所需要的硅酸鹽儀器有 分液漏斗、燒杯分液漏斗、燒杯。
(4)“操作Ⅰ”后,向溶液中加入NaOH溶液來調節溶液的pH,以獲得Ce(OH)3沉淀,常溫下加入NaOH調節溶液的pH應大于 99即可認為Ce3+已完成沉淀。(已知:Ksp[Ce(OH)3]=1.0×10-20)
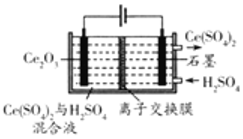
(5)利用電解方法也可以實現鈰的回收。在酸性條件下電解Ce2O3(如圖),離子交換膜為 陽陽(填“陰”或“陽”)離子交換膜。
【考點】物質分離和提純的方法和基本操作綜合應用.
【答案】將鈰氧化為四價便于與其他稀土元素分離;2xCO+CeO2=CeO2(1-x)+2xCO2;8H++2Cl-+2CeO2=2Ce3++Cl2↑+4H2O;過濾;分液漏斗、燒杯;9;陽
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/8/16 1:0:1組卷:15引用:3難度:0.5
相似題
-
1.我國青藏高原的鹽湖中蘊藏著豐富的鋰資源,已探明的儲量約三千萬噸,碳酸鋰制備高純金屬鋰的一種工藝流程如圖。下列有關說法錯誤的是( )
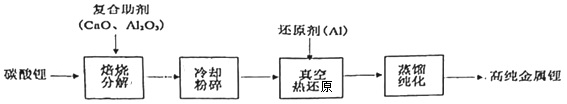
A.金屬鋰可保存在煤油中 B.使用復合助劑有利于碳酸鋰的分解 C.“粉碎”是為了增加接觸面積,加快反應速率 D.真空熱還原發生的主要化學反應為2Al+3Li2O 6Li+Al2O3高溫發布:2025/1/6 7:30:5組卷:28引用:2難度:0.9 -
2.硫鐵礦燒渣是硫鐵礦生產硫酸過程中產生的工業廢渣(主要含Fe2O3及少量SiO2、Al2O3等雜質)。用該燒渣制取藥用輔料-紅氧化鐵的工藝流程如圖:
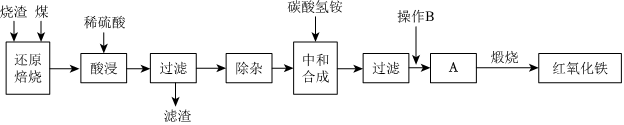
(1)在“還原焙燒”中產生的有毒氣體可能有。
(2)“酸浸”時間一般不超過20min,若在空氣中酸浸時間過長,溶液中Fe2+含量將下降,其原因是(用離子方程式表示)。
(3)“中和合成”的目的是將溶液中Fe2+轉變為碳酸亞鐵沉淀,則操作B是。
(4)煅燒A的反應方程式是。
(5)ag燒渣經過上述工藝可得紅氧化鐵bg。藥典標準規定,制得的紅氧化鐵中含氧化鐵不得少于98.0%,則所選用的燒渣中鐵的質量分數應不低于(用含a、b的表達式表示)。發布:2025/1/19 8:0:1組卷:30引用:1難度:0.5 -
3.查閱資料:CaO、MgO在高溫下與C難反應,但能與SiO2反應.硫鐵礦燒渣是一種工業廢渣(含Fe2O3及少量SiO2、Al2O3、CaO、MgO等雜質),該燒渣可用于制取氧化鐵,具體化工生產工藝流程如下:
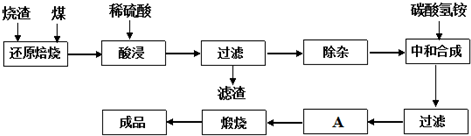
(1)焙燒時產生的主要有害氣體是.
(2)若在空氣中“酸浸”時間過長,溶液中Fe2+含量將下降,其原因是:(用離子方程式表示).
(3)根據下表數據:
在“除雜”步驟中,為除去Fe3+和Al3+,溶液的pH最大值應小于氫氧化物 Al(OH)3 Fe(OH)3 Fe(OH)2 開始沉淀的pH 3.10 2.01 7.11 完全沉淀的pH 4.77 3.68 9.61 ,檢驗Fe3+已經除盡的試劑是(除KSCN外).
(4)“中和合成”的目的是將溶液中Fe2+轉變為碳酸亞鐵沉淀,則A的操作是.發布:2025/1/19 8:0:1組卷:12引用:1難度:0.1


