基于Al2O3載氮體的碳基化學(xué)鏈合成氨技術(shù)示意圖如圖。
 ?
?
(1)總反應(yīng)3C(s)+N2(g)+3H2O(l)=3CO(g)+2NH3(g)ΔH=+434kJ/mol+434kJ/molkJ?mol-1。
(2)有利于提高反應(yīng)i平衡轉(zhuǎn)化率的條件為 BB(填標(biāo)號)。
a.高溫高壓
b.高溫低壓
c.低溫高壓
d.低溫低壓
(3)60℃、100kPa條件下,反應(yīng)ii中溶液pH隨時間變化如圖,120min~180min持續(xù)收集到氨氣,但溶液pH幾乎不變的原因是 溶液中氨水濃度達到飽和溶液中氨水濃度達到飽和。

(4)為探究反應(yīng)ii中15min時反應(yīng)速率突然加快的原因,我國科學(xué)家利用計算機模擬了反應(yīng)ⅱ的反應(yīng)路徑。
?
①比較不同路徑,路徑1能壘(活化絡(luò)合物與反應(yīng)物的零點能之差)較低的原因是 O-H鍵O-H鍵的鍵能大于的 Al-H鍵Al-H鍵鍵能。
?②15min時反應(yīng)速率突然加快的原因是 AlN與水結(jié)合后,生成氨水,氨水電離出OH-對反應(yīng)Ⅱ具有催化作用AlN與水結(jié)合后,生成氨水,氨水電離出OH-對反應(yīng)Ⅱ具有催化作用。
(5)相較于哈伯法合成氨碳基化學(xué)鏈合成氨的優(yōu)勢有 降低能耗、減少原料成本降低能耗、減少原料成本、產(chǎn)物無需分離或獲得CO副產(chǎn)物等產(chǎn)物無需分離或獲得CO副產(chǎn)物等(寫出兩條即可)。
(6)可用0.2mol?L-1AgNO3溶液吸反應(yīng)ⅱ排放出的NH3,AgNO3全部生成Ag(NH3)2NO3而失效。為使吸收液完全再生,向其中加入0.4mol?L-1HNO3溶液調(diào)節(jié)pH至少為 4.54.5。[已知常溫下,Kb(NH3)=2×10-5,Ag++2NH3?Ag(NH3)2+ 的K穩(wěn)=1×107]
【答案】+434kJ/mol;B;溶液中氨水濃度達到飽和;O-H鍵;Al-H鍵;AlN與水結(jié)合后,生成氨水,氨水電離出OH-對反應(yīng)Ⅱ具有催化作用;降低能耗、減少原料成本;產(chǎn)物無需分離或獲得CO副產(chǎn)物等;4.5
【解答】
【點評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:132引用:1難度:0.5
相似題
-
1.下列說法不正確的是( )
A.CH3COOH 溶液加水稀釋后,溶液中 的值減小c(CH3COOH)c(CH3COO-)B.已知一定溫度下,醋酸溶液的物質(zhì)的量濃度為c,電離度為α,Ka= .若加入少量醋酸鈉固體,則CH3COOH?CH3COO-+H+向左移動,α減小,Ka變小(cα)2c(1-α)C.實驗測得環(huán)己烷(l)、環(huán)己烯(l)和苯(l)的標(biāo)準(zhǔn)燃燒熱分別為-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以證明在苯分子中不存在獨立的碳碳雙鍵 D.已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g),△H=+489.0 kJ/mol.
CO(g)+O2(g)═CO2(g),△H=-283.0 kJ/mol.12
C(石墨)+O2(g)═CO2(g),△H=-393.5 kJ/mol.
則4Fe(s)+3O2(g)═2Fe2O3(s),△H=-1641.0 kJ/mol發(fā)布:2025/1/1 8:0:2組卷:11引用:1難度:0.7 -
2.下列與化學(xué)反應(yīng)的能量變化有關(guān)的敘述正確的是( )
A.由石墨比金剛石穩(wěn)定可知,C(金剛石)═C(石墨)△H<0 B.一個反應(yīng)的反應(yīng)物的總能量可能等于其生成物的總能量 C.有熱量變化的反應(yīng)一定是化學(xué)反應(yīng) D.強酸與強堿的中和反應(yīng)的熱化學(xué)方程式均可表示為H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ?mol-1 發(fā)布:2025/1/6 6:0:5組卷:1引用:3難度:0.6 -
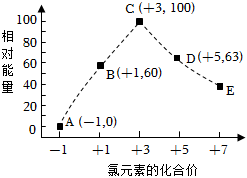 3.一定條件下,在水溶液中物質(zhì)的量均為1mol的Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相對大小如圖所示。圖中最穩(wěn)定的點為( )
3.一定條件下,在水溶液中物質(zhì)的量均為1mol的Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相對大小如圖所示。圖中最穩(wěn)定的點為( )A.A B.B C.C D.D 發(fā)布:2025/1/6 6:0:5組卷:0引用:1難度:0.9
相關(guān)試卷


