某同學想通過利用下圖所示裝置(夾持裝置已略去)實驗,探究SO2與Na2O2反應的產物.
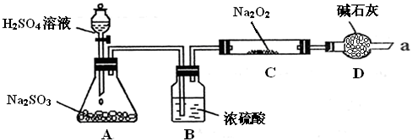
實驗后測得反應前C管的質量為m1 g,反應后C管的質量為m 2 g,反應后裝置D質量增加了n g.請分析:
Ⅰ.裝置B的作用干燥SO2氣體,防止水蒸氣與Na2O2反應干燥SO2氣體,防止水蒸氣與Na2O2反應.裝置D的作用防止空氣中的水蒸氣和二氧化碳進入C裝置與Na2O2反應,同時吸收過量的SO2,以免污染空氣防止空氣中的水蒸氣和二氧化碳進入C裝置與Na2O2反應,同時吸收過量的SO2,以免污染空氣.
Ⅱ.如何檢驗反應中是否有O2生成用帶火星的木條靠近干燥管口a,觀察其是否燃燒用帶火星的木條靠近干燥管口a,觀察其是否燃燒.
Ⅲ.對C中固體產物提出如下假設:
假設1:只有Na2SO3
假設2:只有Na2SO4
假設3:有Na2SO3和Na2SO4有Na2SO3和Na2SO4.
(1)若按假設2進行,反應方程式為Na2O2+SO2=Na2SO4Na2O2+SO2=Na2SO4.
(2)若Na2O2反應完全,為確定C中固體產物的成分,甲同學設計如下實驗:

得出結論:產物是Na2SO4.
該方案是否合理否否(填“是”或“否”),理由是HNO3有氧化性,據此不能確定產物是Na2SO3還是Na2SO4或二者兼有HNO3有氧化性,據此不能確定產物是Na2SO3還是Na2SO4或二者兼有.
(3)若假設1成立,某同學以反應前后C管的質量差( m 2-m 1 )g為依據推斷生成Na2SO3的質量為( m 2-m 1 )×126/64g.老師提示推算不合理,請你分析其中的緣由:因為該反應中吸收SO2同時有O2產生,所以(m2-m1)不等于參加反應的SO2質量,故該推算不合理因為該反應中吸收SO2同時有O2產生,所以(m2-m1)不等于參加反應的SO2質量,故該推算不合理.
(4)若假設2成立,則參加反應的Na2O2物質的量為m2-m164m2-m164 (列計算式)摩爾.
m
2
-
m
1
64
m
2
-
m
1
64
【考點】探究化學反應機理;探究物質的組成或測量物質的含量.
【答案】干燥SO2氣體,防止水蒸氣與Na2O2反應;防止空氣中的水蒸氣和二氧化碳進入C裝置與Na2O2反應,同時吸收過量的SO2,以免污染空氣;用帶火星的木條靠近干燥管口a,觀察其是否燃燒;有Na2SO3和Na2SO4;Na2O2+SO2=Na2SO4;否;HNO3有氧化性,據此不能確定產物是Na2SO3還是Na2SO4或二者兼有;因為該反應中吸收SO2同時有O2產生,所以(m2-m1)不等于參加反應的SO2質量,故該推算不合理;
m
2
-
m
1
64
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:78引用:5難度:0.1
相似題
-
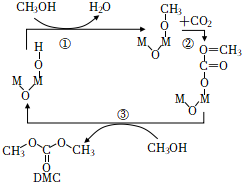 1.碳酸二甲酯(DMC)具有優良的化學反應性能。在眾多研究方向中,CO2和甲醇直接合成 DMC 的方法受到了較多的關注,M2O(OH)催化該反應的一種反應機理如圖所示。下列敘述正確的是( )
1.碳酸二甲酯(DMC)具有優良的化學反應性能。在眾多研究方向中,CO2和甲醇直接合成 DMC 的方法受到了較多的關注,M2O(OH)催化該反應的一種反應機理如圖所示。下列敘述正確的是( )A.M2O(OH)是反應的催化劑,H2O是反應中間體 B.DMC中共面的原子數最多為6個 C.DMC的同分異構體中同時含有羧基和羥基的物質有2種(不考慮立體異構) D.反應①②③均為取代反應 發布:2024/12/30 3:30:1組卷:18引用:2難度:0.6 -
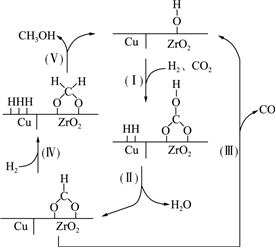 2.氫氣和二氧化碳在催化劑作用下合成甲醇的反應為放熱反應,催化過程可解釋為“吸附-活化-解離”的過程,催化反應機理如圖所示。下列說法正確的是( )
2.氫氣和二氧化碳在催化劑作用下合成甲醇的反應為放熱反應,催化過程可解釋為“吸附-活化-解離”的過程,催化反應機理如圖所示。下列說法正確的是( )A.反應過程中Ⅰ~Ⅴ步,C元素化合價不變 B.單位時間內生成的水越多,則甲醇的產率越大 C.增大催化劑的表面積,可以提高甲醇的平衡產率 D.氫氣和二氧化碳在催化反應過程中有副產物CO生成 發布:2024/11/17 18:0:2組卷:14引用:4難度:0.8 -
3.CO2捕獲和轉化可減少CO2排放并實現資源利用,原理如圖1所示。反應①完成之后,以N2為載氣,以恒定組成的N2、CH4混合氣,以恒定流速通入反應器,單位時間流出氣體各組分的物質的量隨反應時間變化如圖2所示。反應過程中始終未檢測到CO2,在催化劑上有積碳。下列說法不正確的是( )
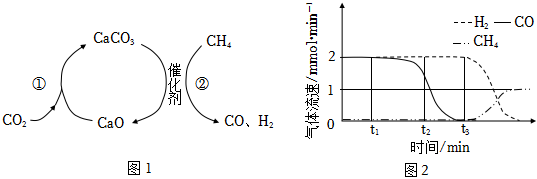
A.反應①為CaO+CO2=CaCO3;反應②為CaCO3+CH4 CaO+2CO+2H2催化劑B.t1~t3,n(H2)比n(CO)多,且生成H2速率不變,可能有副反應CH4 C+2H2催化劑C.t2時刻,副反應生成H2的速率大于反應②生成H2速率 D.t3之后,生成CO的速率為0,是因為反應②不再發生 發布:2024/12/5 13:30:2組卷:103引用:9難度:0.5


