 我國化學(xué)家侯德榜發(fā)明了侯氏制堿法,為世界制堿工業(yè)作出了杰出貢獻。化學(xué)小組同學(xué)為測定某純堿樣品中碳酸鈉的質(zhì)量分數(shù),取12.5g該純堿樣品于燒杯中,加入一定質(zhì)量的水使樣品充分溶解,向所得溶液中逐滴滴加溶質(zhì)質(zhì)量分數(shù)為9.8%的稀硫酸,實驗測得生成氣體的質(zhì)量與滴加稀硫酸的質(zhì)量的關(guān)系如圖所示(雜質(zhì)不溶于水也不參加反應(yīng))。
我國化學(xué)家侯德榜發(fā)明了侯氏制堿法,為世界制堿工業(yè)作出了杰出貢獻。化學(xué)小組同學(xué)為測定某純堿樣品中碳酸鈉的質(zhì)量分數(shù),取12.5g該純堿樣品于燒杯中,加入一定質(zhì)量的水使樣品充分溶解,向所得溶液中逐滴滴加溶質(zhì)質(zhì)量分數(shù)為9.8%的稀硫酸,實驗測得生成氣體的質(zhì)量與滴加稀硫酸的質(zhì)量的關(guān)系如圖所示(雜質(zhì)不溶于水也不參加反應(yīng))。
(1)純堿屬于 鹽鹽(選填“酸”、“堿”或“鹽”)。
(2)當?shù)稳肷鲜鱿×蛩嶂翀D中B點時,燒杯中溶液含有的溶質(zhì)是 Na2SO4、H2SO4Na2SO4、H2SO4(填化學(xué)式)。
(3)計算該純堿樣品中碳酸鈉的質(zhì)量分數(shù)。(寫出計算過程)
(4)在實驗室用濃硫酸配制實驗所用的稀硫酸。
①用濃硫酸配制一定量的稀硫酸時,正確的操作是將 濃硫酸沿器壁慢慢注入水中,并用玻璃棒不斷攪拌濃硫酸沿器壁慢慢注入水中,并用玻璃棒不斷攪拌,并不斷攪拌。
②若量取濃硫酸時俯視讀數(shù)(其他操作正確),則配出的稀硫酸的溶質(zhì)質(zhì)量分數(shù) 小于小于(選填“大于”、“等于”或“小于”)9.8%。
【答案】鹽;Na2SO4、H2SO4;濃硫酸沿器壁慢慢注入水中,并用玻璃棒不斷攪拌;小于
【解答】
【點評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:44引用:1難度:0.5
相似題
-
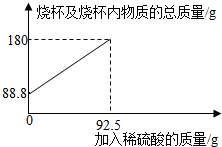 1.為測定某碳素鋼樣品中鐵的質(zhì)量分數(shù),現(xiàn)取一定質(zhì)量的樣品粉末于質(zhì)量為51.8克的燒杯中,然后逐步加入一定質(zhì)量分數(shù)的稀硫酸,當加入92.5g稀硫酸時恰好完全反應(yīng),加入稀硫酸的質(zhì)量與燒杯及燒杯內(nèi)物質(zhì)的總質(zhì)量的關(guān)系如圖。
1.為測定某碳素鋼樣品中鐵的質(zhì)量分數(shù),現(xiàn)取一定質(zhì)量的樣品粉末于質(zhì)量為51.8克的燒杯中,然后逐步加入一定質(zhì)量分數(shù)的稀硫酸,當加入92.5g稀硫酸時恰好完全反應(yīng),加入稀硫酸的質(zhì)量與燒杯及燒杯內(nèi)物質(zhì)的總質(zhì)量的關(guān)系如圖。
(1)該實驗取用的樣品質(zhì)量為g。
(2)反應(yīng)后所得溶液中的溶質(zhì)的質(zhì)量分數(shù)。(寫出計算過程,結(jié)果保留一位小數(shù))
(3)反應(yīng)結(jié)束后,小明不慎向燒杯中多加了10g稀硫酸,若在圖中補繪此過程中稀硫酸的質(zhì)量與燒杯及燒杯內(nèi)物質(zhì)的總質(zhì)量的關(guān)系圖,所得線段的終點位于線段AB延長線的(填:上方、下方或線上)。發(fā)布:2025/1/9 8:0:2組卷:4引用:1難度:0.3 -
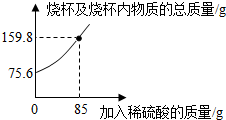 2.為測定某碳素鋼樣品中鐵的質(zhì)量分數(shù),現(xiàn)取一定質(zhì)量的樣品粉末于質(zhì)量為52.2g的燒杯中,然后緩慢加入一定質(zhì)量的稀硫酸,當加稀硫酸質(zhì)量為85g時,反應(yīng)恰好完全(雜質(zhì)不反應(yīng)且產(chǎn)生的氣體全部逸出),反應(yīng)過程中的質(zhì)量關(guān)系如圖.完成下列問題:
2.為測定某碳素鋼樣品中鐵的質(zhì)量分數(shù),現(xiàn)取一定質(zhì)量的樣品粉末于質(zhì)量為52.2g的燒杯中,然后緩慢加入一定質(zhì)量的稀硫酸,當加稀硫酸質(zhì)量為85g時,反應(yīng)恰好完全(雜質(zhì)不反應(yīng)且產(chǎn)生的氣體全部逸出),反應(yīng)過程中的質(zhì)量關(guān)系如圖.完成下列問題:
(1)該實驗取用的樣品質(zhì)量為g.
(2)計算樣品中鐵的質(zhì)量分數(shù)(寫出解題過程).發(fā)布:2025/1/9 8:0:2組卷:139引用:39難度:0.1 -
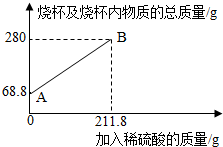 3.為測定某碳素鋼樣品中鐵的質(zhì)量分數(shù),現(xiàn)取一定質(zhì)量的樣品粉末于質(zhì)量為51.8克的燒杯中,然后逐步加入一定質(zhì)量分數(shù)的稀硫酸,當加入211.8g稀硫酸時恰好完全反應(yīng),加入稀硫酸的質(zhì)量與燒杯及燒杯內(nèi)物質(zhì)的總質(zhì)量的關(guān)系如圖。
3.為測定某碳素鋼樣品中鐵的質(zhì)量分數(shù),現(xiàn)取一定質(zhì)量的樣品粉末于質(zhì)量為51.8克的燒杯中,然后逐步加入一定質(zhì)量分數(shù)的稀硫酸,當加入211.8g稀硫酸時恰好完全反應(yīng),加入稀硫酸的質(zhì)量與燒杯及燒杯內(nèi)物質(zhì)的總質(zhì)量的關(guān)系如圖。
(1)該實驗取用的樣品質(zhì)量為g。
(2)求樣品中鐵的質(zhì)量分數(shù);反應(yīng)后所得溶液中的溶質(zhì)的質(zhì)量分數(shù)。(寫出計算過程,結(jié)果保留一位小數(shù))
(3)反應(yīng)結(jié)束后,小明不慎向燒杯中多加了20g稀硫酸,若在圖中補繪此過程中稀硫酸的質(zhì)量與燒杯及燒杯內(nèi)物質(zhì)的總質(zhì)量的關(guān)系圖,所得線段的終點位于線段AB延長線的(填:上方、下方或線上)。發(fā)布:2025/1/9 8:0:2組卷:8引用:1難度:0.3
相關(guān)試卷


