(1)從海水中可提取多種化工原料,如圖是工業上對海水資源進行綜合利用的流程圖。試回答下列問題:
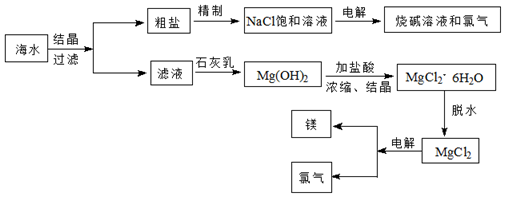
①若粗鹽中含有雜質Ca2+、Mg2+、SO42-,精制時所用試劑為:A.鹽酸;B.BaCl2溶液;C.NaOH溶液;D.Na2CO3溶液。則加入試劑的順序是 CBDACBDA(填序號)。
②電解NaCl飽和溶液產生的NaOH和Cl2可用于制備對新冠病毒有效消殺的“84”消毒液,寫出該反應的離子方程式:Cl2+2OH-=Cl-+ClO-+2H2OCl2+2OH-=Cl-+ClO-+2H2O。
③電解熔融MgCl2可制取鎂和Cl2化學方程式為 MgCl2 電解 Mg+Cl2↑MgCl2 電解 Mg+Cl2↑。其中Cl2和Ca(OH)2反應可制得漂白粉,漂白粉的有效成分是 Ca(ClO)2Ca(ClO)2。
(2)NOx(主要指NO和NO2)是大氣主要污染物之一。有效去除大氣中的NOx是環境保護的重要課題。在催化劑作用下,NH3可與NO2發生如下反應:8NH3+6NO2 催化劑 7N2+12H2O
①該反應的氧化劑是 NO2NO2,還原產物是 N2N2。
②標準狀況下生成15.68LN2,轉移電子為 2.42.4mol。
電解
電解
催化劑
【考點】粗鹽提純.
【答案】CBDA;Cl2+2OH-=Cl-+ClO-+2H2O;MgCl2 Mg+Cl2↑;Ca(ClO)2;NO2;N2;2.4
電解
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:51引用:2難度:0.6
相似題
-
1.為了除去KCl溶液中少量的MgCl2、MgSO4雜質,可選用Ba(OH)2溶液、稀鹽酸和K2CO3溶液三種試劑,按圖步驟操作:
溶液加過量A濾液加過量B操作Ⅰ加過量C較純凈的KCl溶液加熱煮沸
(1)寫出下列試劑的化學式:A,C
(2)根據題意,回答下列問題:
①加入過量A的目的是,
②加入過量B的目的是,
③加熱煮沸的目的是,
(3)操作Ⅰ的名稱是。發布:2024/12/14 8:0:2組卷:53引用:1難度:0.6 -
2.除去粗鹽中的雜質 CaCl2、MgCl2和 Na2SO4,過程如下:

下列有關說法中,不正確的是( )A.除去 Mg2+的主要反應:MgCl2+2NaOH-=Mg(OH)2↓+2NaCl B.試劑①一定不是Na2CO3溶液 C.檢驗 是否除凈:取少量濾液,加稀鹽酸酸化,再加 BaCl2溶液SO2-4D.濾液加稀鹽酸時只發生反應:HCl+NaOH=H2O+NaCl 發布:2024/12/30 4:0:1組卷:123引用:11難度:0.8 -
3.通過海水晾曬可得粗鹽,粗鹽除NaCl外,還含有MgCl2、CaCl2、Na2SO4以及泥沙等雜質,粗鹽精制的實驗流程如下。下列說法不正確的是( )
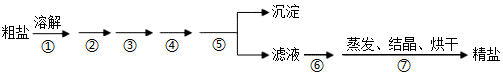
A.在第①步中使用玻璃棒攪拌可加速粗鹽溶解 B.第⑤步操作是過濾 C.在第②③④⑥步通過加入化學試劑除雜,加入試劑順序為:NaOH溶液→Na2CO3溶液→BaCl2溶液→稀鹽酸 D.除去MgCl2的離子方程式為:Mg2++2OH-=Mg(OH)2↓ 發布:2024/12/30 4:30:1組卷:91引用:5難度:0.8


