石蠟油分解可產生乙烯。乙烯是一種重要的化工原料,某同學設計實驗探究工業制備乙烯的原理和乙烯的主要化學性質,實驗裝置如圖所示。

(1)用化學反應方程式解釋B裝置中的實驗現象:CH2=CH2+Br2→CH3Br-CH3BrCH2=CH2+Br2→CH3Br-CH3Br。
(2)C裝置中的現象是 紫色褪色紫色褪色,其發生反應的類型是 氧化反應氧化反應。
(3)查閱資料可知,乙烯與酸性高錳酸鉀溶液反應產生二氧化碳。根據本實驗中裝置 DD(填序號)中的實驗現象可判斷該資料是否真實。
【考點】探究石蠟油分解制乙烯及乙烯的化學性質.
【答案】CH2=CH2+Br2→CH3Br-CH3Br;紫色褪色;氧化反應;D
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:26引用:2難度:0.6
相似題
-
 1.乙烯的實驗室制法:
1.乙烯的實驗室制法:
(1)藥品:、
(2)反應原理:(方程式)
(3)在圓底燒瓶中放入少量碎瓷片是為了防止液體發生
(4)反應中濃硫酸的作用、
(5)將乙烯通入酸性高錳酸鉀溶液中,現象是其反應類型是;
(6)將乙烯通入溴水中,現象是,所發生的化學反應方程式其反應類型是.發布:2024/10/26 17:0:2組卷:155引用:1難度:0.5 -
2.實驗室中用如圖所示裝置模擬工業上用石蠟油分解制乙烯。下列關于該實驗的說法不正確的是( )
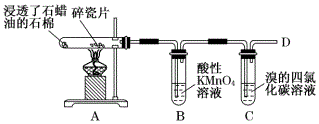
A.根據實驗現象可推知石蠟油分解產生了與烷烴性質不同的烴 B.碎瓷片的作用是做催化劑和使石蠟油附著在高溫的碎瓷片上發生分解 C.試管B和C中褪色原理不同 D.待試管B和C的溶液完全褪色,再在D處點燃氣體,火焰呈淡藍色 發布:2024/11/22 8:0:1組卷:78引用:1難度:0.6 -
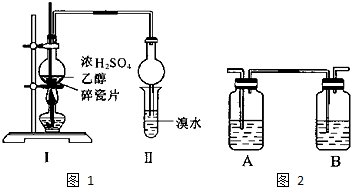 3.1,2二溴乙烷可作汽油抗爆劑的添加劑,常溫下它是無色液體,密度2.189.cm-3,沸點131.4℃,熔點9.79℃,不溶于水,易溶于醇、醚、丙酮等有機溶劑.在實驗室中可用下列反應制備1,2二溴乙烷.
3.1,2二溴乙烷可作汽油抗爆劑的添加劑,常溫下它是無色液體,密度2.189.cm-3,沸點131.4℃,熔點9.79℃,不溶于水,易溶于醇、醚、丙酮等有機溶劑.在實驗室中可用下列反應制備1,2二溴乙烷.
①CH3CH2OHCH2═CH2↑+H2OH2SO4△
②CH2═CH2+Br2→CH2BrCH2Br
某化學興趣小組用如圖1所示的裝置(部分固定和夾持裝置省略)進行探究實驗,以驗證產物中有乙烯生成且乙烯具有不飽和性.當溫度迅速上升后,可觀察到試管中溴水褪色,燒瓶中濃硫酸與乙醇的混合液體變為棕黑色.
回答下列問題:
(1)已知該實驗的副反應之一是乙醇會被濃硫酸氧化成CO2.寫出該反應的化學方程式:.
(2)甲同學認為:溴水褪色的現象不能證明反應中有乙烯生成且乙烯具有不飽和性,其理由是(填正確答案的標號,下同).
A.乙烯與溴水易發生取代反應 B.使溴水褪色的物質,未必是乙烯
C.使溴水褪色的反應,未必是加成反應
D.濃硫酸氧化乙醇生成的乙醛,也會使溴水褪色
(3)乙同學經過仔細觀察后認為試管中另一現象可證明反應中有乙烯生成,該現象是.
(4)丙同學對上述實驗進行了改進,在Ⅰ和Ⅱ之間增加如圖2所示的裝置,則A中的試劑為,其作用是,B中的試劑為,其作用是.
(5)丁同學通過洗滌、蒸餾等操作對1,2一二溴乙烷粗品進行了精制.該洗滌操作用到的主要玻璃儀器是,該儀器在使用前須清洗干凈并.發布:2024/11/7 8:0:2組卷:447引用:1難度:0.5


