醫學上常用雙氧水溶液(過氧化氫和水的混合物)來清洗創口和局部抗菌。小美同學取68.0g某醫用雙氧水溶液放入燒杯中,然后加入2.0g二氧化錳,放在電子秤上,每隔一分鐘觀察一次并記錄,燒杯中的剩余物質質量如表所示,直到實驗結束。請回答下列問題:
| 稱量時間(分鐘) | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| 質量(g) | 70.0 | 69.3 | 68.9 | 68.6 | 68.4 | m | 68.4 |
無氣泡產生
無氣泡產生
;從表格可知,反應結束的時間是第 4
4
分鐘,m數值是 68.4
68.4
g,該實驗一共生成 1.6
1.6
g氧氣。(2)求該醫用雙氧水溶液中過氧化氫的質量是多少(寫出計算過程)。
(3)實際上測得的雙氧水溶液中過氧化氫的質量比理論值大的原因可能是
實驗過程中有部分水分蒸發
實驗過程中有部分水分蒸發
。【考點】根據化學反應方程式的計算.
【答案】無氣泡產生;4;68.4;1.6;實驗過程中有部分水分蒸發
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:164引用:2難度:0.6
相似題
-
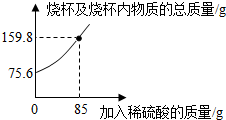 1.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為52.2g的燒杯中,然后緩慢加入一定質量的稀硫酸,當加稀硫酸質量為85g時,反應恰好完全(雜質不反應且產生的氣體全部逸出),反應過程中的質量關系如圖.完成下列問題:
1.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為52.2g的燒杯中,然后緩慢加入一定質量的稀硫酸,當加稀硫酸質量為85g時,反應恰好完全(雜質不反應且產生的氣體全部逸出),反應過程中的質量關系如圖.完成下列問題:
(1)該實驗取用的樣品質量為g.
(2)計算樣品中鐵的質量分數(寫出解題過程).發布:2025/1/9 8:0:2組卷:139引用:39難度:0.1 -
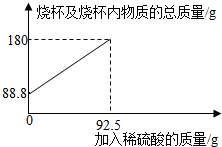 2.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為51.8克的燒杯中,然后逐步加入一定質量分數的稀硫酸,當加入92.5g稀硫酸時恰好完全反應,加入稀硫酸的質量與燒杯及燒杯內物質的總質量的關系如圖。
2.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為51.8克的燒杯中,然后逐步加入一定質量分數的稀硫酸,當加入92.5g稀硫酸時恰好完全反應,加入稀硫酸的質量與燒杯及燒杯內物質的總質量的關系如圖。
(1)該實驗取用的樣品質量為g。
(2)反應后所得溶液中的溶質的質量分數。(寫出計算過程,結果保留一位小數)
(3)反應結束后,小明不慎向燒杯中多加了10g稀硫酸,若在圖中補繪此過程中稀硫酸的質量與燒杯及燒杯內物質的總質量的關系圖,所得線段的終點位于線段AB延長線的(填:上方、下方或線上)。發布:2025/1/9 8:0:2組卷:4引用:1難度:0.3 -
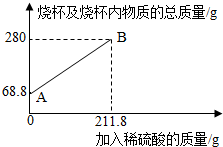 3.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為51.8克的燒杯中,然后逐步加入一定質量分數的稀硫酸,當加入211.8g稀硫酸時恰好完全反應,加入稀硫酸的質量與燒杯及燒杯內物質的總質量的關系如圖。
3.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為51.8克的燒杯中,然后逐步加入一定質量分數的稀硫酸,當加入211.8g稀硫酸時恰好完全反應,加入稀硫酸的質量與燒杯及燒杯內物質的總質量的關系如圖。
(1)該實驗取用的樣品質量為g。
(2)求樣品中鐵的質量分數;反應后所得溶液中的溶質的質量分數。(寫出計算過程,結果保留一位小數)
(3)反應結束后,小明不慎向燒杯中多加了20g稀硫酸,若在圖中補繪此過程中稀硫酸的質量與燒杯及燒杯內物質的總質量的關系圖,所得線段的終點位于線段AB延長線的(填:上方、下方或線上)。發布:2025/1/9 8:0:2組卷:8引用:1難度:0.3


