短周期原子序數依次遞增的A、B、C、D、E、F六種元素,已知B原子最外層電子數是A原子次外層電子數的3倍,是D原子最外層電子數的2倍;C原子內層電子總數是最外層電子數10倍;A、B、D三種元素的原子最外層電子數之和為13;A和B原子最外層電子數之和與D和F原子最外層電子數之和相等;E和F是相鄰元素。回答下列問題:
(1)E元素的名稱為硫硫;其在元素周期表中的位置是第三周期第ⅥA族第三周期第ⅥA族。
(2)AB2的電子式為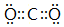
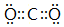 ;用電子式表示E的氫化物的形成過程
;用電子式表示E的氫化物的形成過程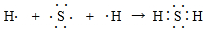
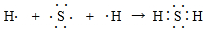 。
。
(3)C和F元素的最高價氧化物的水化物反應的化學方程式為NaOH+HClO4=NaClO4+H2ONaOH+HClO4=NaClO4+H2O;
(4)B、C、D、F四種元素原子半徑由大到小的順序是Na>Al>S>ONa>Al>S>O(填元素符號),離子半徑最小的是Al3+Al3+(填離子符號)。
(5)B和E的簡單氫化物中沸點較高的是H2OH2O(填化學式),A和B的簡單氫化物中穩定性較好的是H2OH2O(填化學式)。
(6)短周期元素M與D元素位于不同主族,根據對角線規則二者某些性質相似。將M的最高價氧化物溶于C的最高價氧化物對應的水化物溶液中,發生反應的離子方程式為BeO+2OH-=BeO22-+H2OBeO+2OH-=BeO22-+H2O。
(7)由B、C兩種元素組成的化合物有兩種,其中一種為淡黃色,該物質的電子式為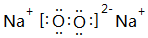
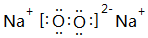 。
。
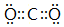
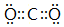
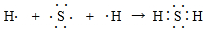
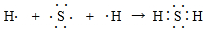
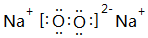
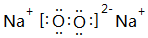
【考點】位置結構性質的相互關系應用.
【答案】硫;第三周期第ⅥA族;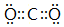 ;
;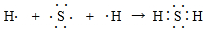 ;NaOH+HClO4=NaClO4+H2O;Na>Al>S>O;Al3+;H2O;H2O;BeO+2OH-=BeO22-+H2O;
;NaOH+HClO4=NaClO4+H2O;Na>Al>S>O;Al3+;H2O;H2O;BeO+2OH-=BeO22-+H2O;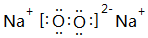
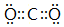 ;
;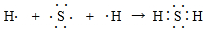 ;NaOH+HClO4=NaClO4+H2O;Na>Al>S>O;Al3+;H2O;H2O;BeO+2OH-=BeO22-+H2O;
;NaOH+HClO4=NaClO4+H2O;Na>Al>S>O;Al3+;H2O;H2O;BeO+2OH-=BeO22-+H2O;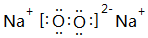
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/7/20 8:0:8組卷:19引用:2難度:0.5
相似題
-
1.X、Y、Z、M、N均為短周期主族元素,原子序數依次增大。X是宇宙中含量最高的元素,YX3分子呈三角錐形,Z的價電子排布式為nsnnpn+2,五種元素中M的電負性最小,N的最高價含氧酸酸性最強。下列說法正確的是( )
A. 的VSEPR模型為V形YZ-2B.由X、Y、Z三種元素組成的化合物的水溶液均顯酸性 C.同周期中第一電離能大于Z的元素有3種 D.MN晶體中M離子的配位數為8 發布:2025/1/5 8:0:1組卷:47引用:1難度:0.5 -
2.A、B、C、D、E為原子序數依次增大的五種短周期元素;A是宇宙中最豐富的元素且與E同主族;B位于元素周期表ⅣA族;C在元素周期表中與B、D相鄰;D基態原子的s軌道與p軌道的電子總數相等且p軌道有2個未成對的電子;E是短周期中原子半徑最大的元素;F原子核外電子數為29.回答下列問題:
(1)F基態原子的核外電子排布式為。
(2)A、B、C、D、E五種元素中,電負性最小的元素為(填元素符號,下同),第一電離能最大的元素為;A3D+的立體構型為。
(3)A、B可形成多種化合物,其中相對分子質量為28的分子,其中心原子的雜化方式為,該分子中σ鍵和π鍵的數目之比為。
(4)化合物BD2和E2D2的晶體類型分別為、。
(5)F單質為面心立方晶體,若F的相對原子質量為M,阿伏加德羅常數為NA,晶胞邊長為a cm,則晶體F的密度ρ=g?cm-3。發布:2025/1/18 8:0:1組卷:27引用:2難度:0.3 -
3.已知A、B、C、D、E、F、G都是短周期的元素,它們的原子序數依次遞增.A原子的電子層數與它的核外電子總數相同,而B原子的最外層電子數是次外層的2倍,C的氫化物可使濕潤的紅色石蕊試紙變藍,B和D可以形成兩種氣態化合物,E原子核外電子總數比B的2倍少1,D與F同主族,G的原子半徑是本周期元素中最小的.則:
(1)A元素為C元素為E元素為
(2)由上述元素形成的10電子分子有、.
(3)由B和D以質量比為3:8組成的化合物與E的同周期相鄰主族元素的單質反應的化學方程式為.
(4)G單質與E的最高價氧化物的水化物反應的離子方程式為
(5)B、C、D形成的氣態氫化物中,較穩定的是
(6)由A、C、G形成的離子化合物的化學式是.發布:2024/12/30 18:30:1組卷:7引用:3難度:0.5


