以NH3還原NOx的選擇性催化還原(NH3-SCR)技術廣泛應用于煙氣(含NO、O2、N2等)脫硝。
(1)NOx大量排放造成的環境問題主要有:酸雨、光化學煙霧、破壞臭氧層酸雨、光化學煙霧、破壞臭氧層(填一種)。
(2)以Fe-Mn/TiO2催化的NH3-SCR反應機理如圖所示(字母A~D為中間體的代號)。
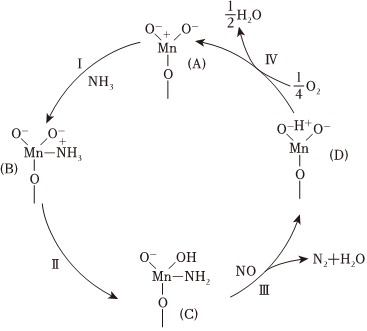
①NH3-SCR反應的化學方程式為 4NH3+4NO+O2 Fe-Mn/TiO2 4N2+6H2O4NH3+4NO+O2 Fe-Mn/TiO2 4N2+6H2O。
②根據元素電負性的變化規律,步驟Ⅰ、Ⅱ的過程可描述為 NH3中帶部分負電荷的N與A中帶正電荷的Mn作用生成B,B中帶部分正電荷的H轉移到帶負電荷的O上生成CNH3中帶部分負電荷的N與A中帶正電荷的Mn作用生成B,B中帶部分正電荷的H轉移到帶負電荷的O上生成C。
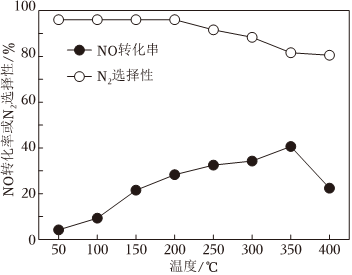
(3)常壓下,將一定比例的NH3、NO、O2、N2的混合氣體勻速通過裝有催化劑的反應管,測得NO的轉化率與N2的選擇性[2n生成(N2)n總轉化(NH3)]如圖所示。溫度高于350℃,N2選擇性下降的原因是 催化劑活性降低,NH3轉化為N2的速率降低;部分NH3被氧化為NO催化劑活性降低,NH3轉化為N2的速率降低;部分NH3被氧化為NO。
(4)研究NH3-SCR法尾氣中NH3脫除機理的流程如圖1所示。其他條件一定時,在不通O2、通入O2兩種情況下,NH3的脫除率、NO的選擇性[n生成(NO)n總轉化(NH3)]與通氣時間的關系如圖2所示。
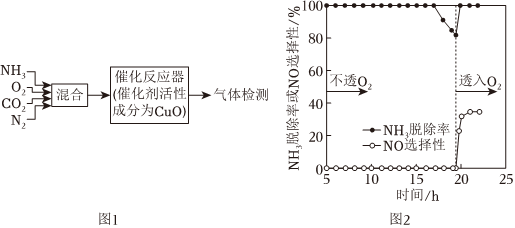
①反應17~19.2h時,NH3脫除率下降,其原因是 該時間段內發生的反應為NH3與CuO反應生成Cu(或Cu2O)和N2,隨時間推移,CuO與Cu2O的量減少,NH3氧化為N2的速率降低該時間段內發生的反應為NH3與CuO反應生成Cu(或Cu2O)和N2,隨時間推移,CuO與Cu2O的量減少,NH3氧化為N2的速率降低。
②通入O2后,NO選擇性增大,其原因是 隨時間推移,Cu被O2氧化為CuO的量增多,NH3被CuO催化氧化成NO的量增大隨時間推移,Cu被O2氧化為CuO的量增多,NH3被CuO催化氧化成NO的量增大。
F
e
-
M
n
/
T
i
O
2
F
e
-
M
n
/
T
i
O
2
2
n
生成
(
N
2
)
n
總轉化
(
N
H
3
)
n
生成
(
NO
)
n
總轉化
(
N
H
3
)
【答案】酸雨、光化學煙霧、破壞臭氧層;4NH3+4NO+O2 4N2+6H2O;NH3中帶部分負電荷的N與A中帶正電荷的Mn作用生成B,B中帶部分正電荷的H轉移到帶負電荷的O上生成C;催化劑活性降低,NH3轉化為N2的速率降低;部分NH3被氧化為NO;該時間段內發生的反應為NH3與CuO反應生成Cu(或Cu2O)和N2,隨時間推移,CuO與Cu2O的量減少,NH3氧化為N2的速率降低;隨時間推移,Cu被O2氧化為CuO的量增多,NH3被CuO催化氧化成NO的量增大
F
e
-
M
n
/
T
i
O
2
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:93引用:1難度:0.7
相似題
-
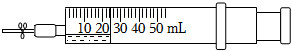 1.如圖所示,在一支50mL的注射器里充入20mL NO,然后吸入5mL水,用乳膠管和彈簧夾封住管口。
1.如圖所示,在一支50mL的注射器里充入20mL NO,然后吸入5mL水,用乳膠管和彈簧夾封住管口。
(1)根據操作步驟,完成表格:
(2)如果要將注射器中的NO充分轉化,可以采取什么措施?操作步驟河 實驗現象 解釋原因 Ⅰ.振蕩注射器,觀察現象 無明顯現象 ① Ⅱ.打開彈簧夾,快速吸入10mL空氣后夾上彈簧夾,觀察現象 ② ③ Ⅲ.振蕩注射器,再觀察現象 氣體又變為無色,注射器的活塞向內移動 ④ 。
(3)上述實驗對工業上生產硝酸有什么啟示?。發布:2024/12/30 6:30:2組卷:9引用:3難度:0.6 -
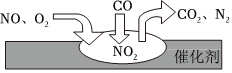 2.隨著我國汽車年銷量的大幅增加,空氣環境受到了很大的污染。汽車尾氣凈化裝置里,氣體在催化劑表面吸附與解吸作用的過程如圖所示,下列說法正確的是( )
2.隨著我國汽車年銷量的大幅增加,空氣環境受到了很大的污染。汽車尾氣凈化裝置里,氣體在催化劑表面吸附與解吸作用的過程如圖所示,下列說法正確的是( )A.該轉化過程中N元素化合價降低,C元素化合價升高,共兩種元素化合價發生變化 B.汽車尾氣的主要污染成分包括CO、NO和N2 C.NO和O2必須在催化劑表面才能反應 D.催化轉化的總化學方程式為2NO+O2+4CO 4CO2+N2催化劑發布:2024/12/30 6:30:2組卷:9引用:2難度:0.6 -
3.下列有關NO2的敘述正確的是( )
A.閃電時,空氣中的N2和O2可直接化合生成NO2 B.NO2與水反應時,NO2作還原劑,水作氧化劑 C.NO2、NO都是大氣污染氣體,在空氣中都能穩定存在 D.NO2是紅棕色有毒氣體 發布:2024/12/30 6:30:2組卷:7引用:2難度:0.7
相關試卷


