認識和運用水溶液中的離子反應及其平衡原理,有助于指導工農業生產和科學研究.
(1)已知室溫下
| 化學式 | H2CO3 | H2C2O4 |
| 電離常數 | Kal=4.2×10-7 Ka2=4.8×10-11 |
Kal=5.6×10-2 Ka2=5.4×10-5 |
>
>
(填“>”“<”或“=”)0.1mol?L-1Na2C2O4溶液的pH.②等濃度H2C2O4溶液和H2CO3溶液中,氫離子濃度較大的是
草酸(H2C2O4)
草酸(H2C2O4)
.③若將等濃度的H2C2O4溶液和H2CO3溶液等體積混合,溶液中各種粒子濃度大小的順序正確的是
AC
AC
.A.c(H+)>c(HC2O4-)>c(HCO3-)>c(CO32-)
B.c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-)
C.c(H+)>c(HC2O4-)>c(C2O42-)>c(CO32-)
D.c(H2CO3)>c(HCO3-)>c(HC2O4-)>c(CO32-)
(2)向Na2CO3溶液中滴加少量H2C2O4溶液,寫出發生反應的離子方程式:
2CO32-+H2C2O4=2HCO3-+C2O42-
2CO32-+H2C2O4=2HCO3-+C2O42-
.SO2會對環境和人體健康帶來極大的危害,工業上采取多種方法減少SO2的排放.
方法1(雙堿法):用NaOH溶液吸收SO2,并用CaO使NaOH再生NaOH溶液
S
O
2
C
a
O
(3)①寫出過程的離子方程式:
2OH-+SO2=SO32-+H2O
2OH-+SO2=SO32-+H2O
.②CaO在水中存在如下轉化:CaO(s)+H2O(l)═Ca(OH)2(s)?Ca2+(aq)+2OH-(aq),從平衡移動的角度,簡述過程ⅱ中NaOH再生的原理:
SO32-與Ca2+生成CaSO3沉淀,平衡正向移動,有NaOH生成
SO32-與Ca2+生成CaSO3沉淀,平衡正向移動,有NaOH生成
.(4)方法2:用亞硫酸鹽(X)吸收煙氣中的SO2,會生成酸式鹽(HSO3-).
①已知NaHSO3溶液呈酸性,比較Na+以及溶液中各種含硫元素微粒的濃度大小關系
c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)>c(H2SO3)
c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)>c(H2SO3)
.②已知用亞硫酸鹽(X)吸收SO2的過程中含硫組分物質的量分數(δ)與溶液pH的變化關系如圖所示.下列說法錯誤的是
②
②
.(填編號)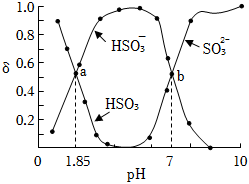
①若X為Na2SO3,當吸收液呈中性時,2c(SO32-)+c(HSO3-)=c(Na+)
②若X為Na2SO3,當吸收液pH=1.85時,c(Na+)=2c(SO32-)+4c(H2SO3)
③若X為(NH4)2SO3,(NH4)2SO3溶液呈堿性,說明水解程度:SO32->NH4+
④若X為(NH4)2SO3,圖中b點溶液中n(HSO3-):n(NH4+)=1:3
【答案】>;草酸(H2C2O4);AC;2CO32-+H2C2O4=2HCO3-+C2O42-;2OH-+SO2=SO32-+H2O;SO32-與Ca2+生成CaSO3沉淀,平衡正向移動,有NaOH生成;c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)>c(H2SO3);②
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:41引用:1難度:0.7
相似題
-
1.在25℃時,對于0.1moL?L-1CH3COONa溶液的說法正確的是( )
A.加水稀釋后,溶液中 的值不變c(CH3COO-)c(CH3COOH)?c(OH-)B.加入少量NaOH固體,c(CH3COO-)減小 C.該溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) D.與0.1mol?L-1硝酸等體積混合后:c(Na+)=c(NO3-)>c(CH3COO-)>c(H+)>c(OH-) 發布:2025/1/1 8:0:2組卷:18引用:0難度:0.9 -
2.白醋是烹調中的酸味輔料,能改善調節人體的新陳代謝,其主要成分CH3COOH為一元弱酸。25℃時,下列有關說法正確的是( )
A.pH=3的CH3COOH溶液中,存在c(H+)=c(CH3COOH)+c(CH3COO-) B.pH=7的CH3COONH4溶液中,c(CH3COO-)=c(NH4+)>c(H+)=c(OH-) C.pH=5的CH3COOH溶液中,水電離產生的c(H+)=10-5mol/L D.pH=10的CH3COONa溶液中,c(CH3COO-)>c(Na+)>c(OH-)>c(H+) 發布:2024/12/30 11:30:1組卷:300引用:5難度:0.6 -
3.下列有關說法正確的是( )
A.常溫下,0.1 mol?L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+2c(H2S) B.常溫下,0.1 mol?L-1HA溶液與0.1 mol?L-1 NaOH溶液正好完全反應時,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+)
c(CH3COO-)c(CH3COOH)C.常溫下,向0.1 mol?L-1CH3COOH 溶液加水稀釋,當溶液的pH從3.0升到4.0時,溶液中 的值增大到原來的10倍c(CH3COO-)c(CH3COOH)D.常溫下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol?L-1:c(Na+)=c(CH3COOH)>c(CH3COO-)>c(H+)=c(OH-) 發布:2025/1/1 8:0:2組卷:12引用:1難度:0.5


