當前位置:
試題詳情
酸、堿、鹽是初中化學學習的三類重要物質,在生產生活中有重要的用途。
(1)濃硫酸在實驗室常用作干燥劑,因為濃硫酸有吸水吸水性。
(2)鹽酸的下列用途中,不能用硫酸代替鹽酸的是②③②③(填編號)。
①金屬表面除銹
②制造藥物氯化鋅
③除去NaCl中的少量NaOH
(3)如圖是某化學小組測得向一定量稀硫酸中滴入氫氧化鈉溶液發生中和反應時的pH變化圖象。

①a點溶液中溶質的化學式為Na2SO4和H2SO4Na2SO4和H2SO4。
②若保持原稀硫酸的量不變,改用ng與原氫氧化鈉溶液等濃度的氫氧化鈣溶液與其反應,向反應后的溶液中滴加紫色石蕊試液,則溶液變藍色藍色(填“紅色”“藍色”或“紫色”)。
(4)實驗室選用以下裝置制取純凈、干燥的CO2,并探究其與氫氧化鈉溶液的反應。
①B裝置的作用是除去CO2中混有的HCl除去CO2中混有的HCl。
②請在D中簡要畫出將CO2通入盛NaOH溶液的實驗裝置。
③請設計實驗,檢驗反應后D裝置內溶液里溶質的成分,簡要寫出實驗步驟、現象、結論取反應后D裝置中的溶液少許于試管中,加入足量的CaCl2溶液充分反應;產生白色沉淀,說明溶質有Na2CO3;靜置后取上層清液,再滴加無色酚酞溶液;若溶液變紅色說明溶質還有NaOH,若溶液不變色說明溶質無NaOH取反應后D裝置中的溶液少許于試管中,加入足量的CaCl2溶液充分反應;產生白色沉淀,說明溶質有Na2CO3;靜置后取上層清液,再滴加無色酚酞溶液;若溶液變紅色說明溶質還有NaOH,若溶液不變色說明溶質無NaOH。
(5)為了測定銅鋅合金樣品中鋅的含量,稱取樣品20g于燒杯中,向其中加入50g稀硫酸至恰好完全反應,反應后燒杯中物質的總質量為69.8g。請計算:樣品中鋅的質量分數。
【答案】吸水;②③;Na2SO4和H2SO4;藍色;除去CO2中混有的HCl;取反應后D裝置中的溶液少許于試管中,加入足量的CaCl2溶液充分反應;產生白色沉淀,說明溶質有Na2CO3;靜置后取上層清液,再滴加無色酚酞溶液;若溶液變紅色說明溶質還有NaOH,若溶液不變色說明溶質無NaOH
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/11/5 8:0:2組卷:33引用:1難度:0.5
相似題
-
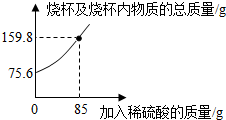 1.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為52.2g的燒杯中,然后緩慢加入一定質量的稀硫酸,當加稀硫酸質量為85g時,反應恰好完全(雜質不反應且產生的氣體全部逸出),反應過程中的質量關系如圖.完成下列問題:
1.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為52.2g的燒杯中,然后緩慢加入一定質量的稀硫酸,當加稀硫酸質量為85g時,反應恰好完全(雜質不反應且產生的氣體全部逸出),反應過程中的質量關系如圖.完成下列問題:
(1)該實驗取用的樣品質量為g.
(2)計算樣品中鐵的質量分數(寫出解題過程).發布:2025/1/9 8:0:2組卷:139引用:39難度:0.1 -
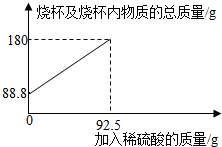 2.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為51.8克的燒杯中,然后逐步加入一定質量分數的稀硫酸,當加入92.5g稀硫酸時恰好完全反應,加入稀硫酸的質量與燒杯及燒杯內物質的總質量的關系如圖。
2.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為51.8克的燒杯中,然后逐步加入一定質量分數的稀硫酸,當加入92.5g稀硫酸時恰好完全反應,加入稀硫酸的質量與燒杯及燒杯內物質的總質量的關系如圖。
(1)該實驗取用的樣品質量為g。
(2)反應后所得溶液中的溶質的質量分數。(寫出計算過程,結果保留一位小數)
(3)反應結束后,小明不慎向燒杯中多加了10g稀硫酸,若在圖中補繪此過程中稀硫酸的質量與燒杯及燒杯內物質的總質量的關系圖,所得線段的終點位于線段AB延長線的(填:上方、下方或線上)。發布:2025/1/9 8:0:2組卷:4引用:1難度:0.3 -
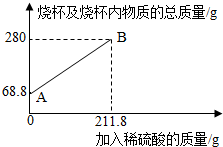 3.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為51.8克的燒杯中,然后逐步加入一定質量分數的稀硫酸,當加入211.8g稀硫酸時恰好完全反應,加入稀硫酸的質量與燒杯及燒杯內物質的總質量的關系如圖。
3.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為51.8克的燒杯中,然后逐步加入一定質量分數的稀硫酸,當加入211.8g稀硫酸時恰好完全反應,加入稀硫酸的質量與燒杯及燒杯內物質的總質量的關系如圖。
(1)該實驗取用的樣品質量為g。
(2)求樣品中鐵的質量分數;反應后所得溶液中的溶質的質量分數。(寫出計算過程,結果保留一位小數)
(3)反應結束后,小明不慎向燒杯中多加了20g稀硫酸,若在圖中補繪此過程中稀硫酸的質量與燒杯及燒杯內物質的總質量的關系圖,所得線段的終點位于線段AB延長線的(填:上方、下方或線上)。發布:2025/1/9 8:0:2組卷:8引用:1難度:0.3


