為測定某黃銅(假設合金中僅含銅、鋅)中銅的質量分數,小科稱取10g黃銅粉末于燒杯中,將40g稀硫酸分四次加入,充分反應,測得實驗數據如下表所示:
| 實驗次數 | 1 | 2 | 3 | 4 |
| 加入稀硫酸的質量/g | 10 | 10 | 10 | 10 |
| 燒杯中剩余物的質量/g | 19.96 | 29.92 | 39.90 | 49.90 |
一、二
一、二
次實驗所加稀硫酸不足。(2)黃銅粉末完全反應生成氫氣的總質量為
0.1
0.1
g(3)該黃銅中銅的質量為多少?稀硫酸的溶質質量分數為多少?
(4)將第3次實驗中燒杯中的剩余物進行過濾,所得濾液中的溶質為
ZnSO4和H2SO4
ZnSO4和H2SO4
。【考點】根據化學反應方程式的計算.
【答案】一、二;0.1;ZnSO4和H2SO4
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:5引用:1難度:0.5
相似題
-
1.小金為測定某樣品中氧化銅的質量分數,稱量固體樣品20.0克,用如圖所示的裝置進行實驗(雜質不參與反應且生成水完全被吸收),實驗中共消耗0.6克氫氣,測得B裝置反應前后的質量增加了3.6克。
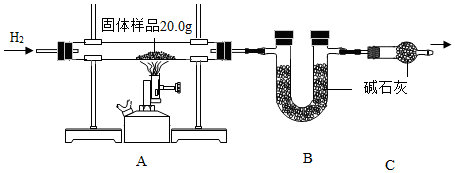
(1)C裝置的作用是;
(2)計算固體樣品中氧化銅的質量分數(根據化學方程式列式計算)。發布:2024/12/28 15:30:1組卷:12引用:2難度:0.5 -
 2.紹興盛產一種四角菱,稱“馱背白”。其菱肉富含淀粉等多種營養物質,此外菱角的莖和根富含纖維素(C6H10O5)n,也是一種很不錯的食物和藥材。
2.紹興盛產一種四角菱,稱“馱背白”。其菱肉富含淀粉等多種營養物質,此外菱角的莖和根富含纖維素(C6H10O5)n,也是一種很不錯的食物和藥材。
(1)菱肉中的鈣、磷、鐵等元素是以(填“單質”或“化合物”)的形態存在;
(2)該纖維素中C、H、O元素的質量比(最簡比);
(3)查閱資料獲悉菱肉制成的菱粉質細爽滑,為淀粉中之佳品。求菱葉產生3.6千克淀粉[有機物(CH2O)n]的同時,光合作用產生氧氣多少千克?(已知光合作用的化學方程式為:nCO2+nH2O═(CH2O)n+nO2,條件忽略)發布:2025/1/6 8:0:1組卷:4引用:1難度:0.5 -
3.侯德榜是我國著名的化學家,發明了侯氏制堿法,其反應原理如下:NaCl+CO2+NH3+H2O═NaHCO3+NH4Cl,請回答:
(1)反應產物中NH4C1可以用于農業生產,它屬于化肥中的肥。
(2)生產16.8t碳酸氫鈉,理論上需要氯化鈉的質量是多少?發布:2024/12/28 15:30:1組卷:12引用:2難度:0.5


