按要求回答下列問題:
(1)下列變化中屬于吸熱反應的是
①鋁片與稀鹽酸的反應 ②將膽礬加熱變為白色粉末
③干冰汽化 ④氯酸鉀分解制氧氣
⑤甲烷在氧氣中的燃燒反應⑥NaHCO3與鹽酸的反應
(2)反應C(s)+H2O(g)?CO(g)+H2(g)在一個容積可變的密閉容器中進行,下列條件的改變對其反應速率幾乎無影響的是
①增加C的量
②將容器的體積縮小一半
③保持體積不變,充入N2使體系壓強增大
④保持壓強不變,充入N2使容器體積變大
(3)在體積為1L的密閉容器中,充入1molCO2和3molH2,一定條件下反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),測得CO2和CH3OH(g)的濃度隨時間變化如圖1所示:
①從3min到9min,υ(H2)=0.13mol/(L?min)0.13mol/(L?min)(結果保留兩位有效數字);a點時v(正) >>v(逆)(填>、<或=,下同);第9分鐘時υ逆(CH3OH) <<第3分鐘時υ正(CH3OH);
②若已知生成標準狀況下2.24LCH3OH(g)時放出熱量為4.9kJ,而上述反應的實際放熱量總小于49kJ,其原因是 該反應是可逆反應,1molCO2和3molH2不可能完全反應,所以放出的熱量總是小于49kJ該反應是可逆反應,1molCO2和3molH2不可能完全反應,所以放出的熱量總是小于49kJ。
(4)微生物燃料電池是指在微生物的作用下將化學能轉化為電能的裝置。某微生物燃料電池的工作原理如圖2所示。
①該微生物燃料電池,負極為 aa(填“a”或“b”);
②該電池正極電極反應式為 O2+4e-+4H+=2H2OO2+4e-+4H+=2H2O。
③當電路中有0.5mol電子發生轉移,則有 0.50.5mol的H+通過質子交換膜。
【答案】0.13mol/(L?min);>;<;該反應是可逆反應,1molCO2和3molH2不可能完全反應,所以放出的熱量總是小于49kJ;a;O2+4e-+4H+=2H2O;0.5
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:53引用:3難度:0.5
相似題
-
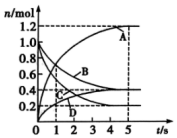 1.一定溫度下,向容積為2L的密閉容器中通入兩種氣體發生化學反應,反應中各物質的物質的量變化如圖所示。則下列對該反應的推斷合理的是( )
1.一定溫度下,向容積為2L的密閉容器中通入兩種氣體發生化學反應,反應中各物質的物質的量變化如圖所示。則下列對該反應的推斷合理的是( )A.該反應的化學方程式為6A+2D?3B+4C B.0~1s內,v(A)=v(B) C.5s時,v(A)=v(B)=v(C)=v(D) D.0~5s內,B的平均反應速率為0.06mol/(L?s) 發布:2024/12/30 19:30:2組卷:32引用:3難度:0.7 -
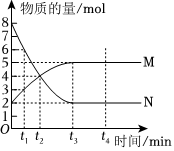 2.一定溫度下,在容積為VL的密閉容器中進行反應:aN(g)?bM(g),M、N的物質的量隨時間的變化曲線如圖所示,下列說法錯誤的是( )
2.一定溫度下,在容積為VL的密閉容器中進行反應:aN(g)?bM(g),M、N的物質的量隨時間的變化曲線如圖所示,下列說法錯誤的是( )A.此反應的化學方程式中a:b=2:1 B.t3時刻該反應達到化學平衡 C.當混合氣體的總質量不隨時間的變化而變化時反應達到平衡狀態 D.任意時刻都滿足v(N)正=2v(M)正 發布:2024/12/30 14:30:1組卷:17引用:2難度:0.7 -
3.一定溫度下,在容積為2L的密閉容器中,與同一個化學反應有關的A、B、C、D(其中A、B、C均為氣體)四種物質的物質的量隨反應時間的變化如圖所示。E為該反應的另一種氣態生成物,且在化學方程式中E的化學計量數與B的相同。請回答下列問題:
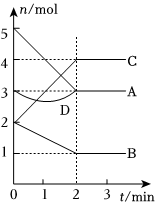
(1)該反應的反應物為。
(2)0~2min內,v(C)=,v(E)=。
(3)若降低溫度,則v(正)(填“加快”、“減慢”或“不變”,下同),v(逆)。
(4)該反應達到平衡狀態的標志有。(填序號)
a.A和C的物質的量相等
b.B的物質的量保持不變
c.A的正反應速率與B的逆反應速率之比為2:1
d.容器內壓強不變
(5)物質D在反應中的作用是。發布:2024/12/30 14:30:1組卷:10引用:3難度:0.7


