 氮氧化物和 SO2是大氣主要污染物,研究它們的轉化關系有利于防治污染。
氮氧化物和 SO2是大氣主要污染物,研究它們的轉化關系有利于防治污染。
已知:Ⅰ.2NO(g)+O2(g)?2NO2(g)△H=-113.0 kJ?mol-1
Ⅱ.2SO2(g)+O2(g)?2SO3(g)△H=-196.6 kJ?mol-1
Ⅲ.NO2(g)+SO2(g)?SO3(g)+NO(g)△H
(1)△H=-41.8kJ/mol-41.8kJ/mol。
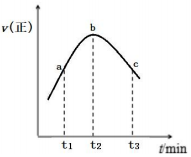
(2)在100℃時,將1mol NO2與1mol SO2的混合氣體置于絕熱恒容密閉容器中發生反應,正反應速率隨時間變化的趨勢如圖所示,a、b、c三點對應條件下的平衡常數分別表示為Ka、Kb、Kc,則Ka、Kb、Kc的大小關系為 Kb<Ka<KcKb<Ka<Kc,下列說法正確的是 CC。(填字母)
A.反應在b點達到平衡狀態
B.從t1到t3逆反應的速率先增大后減小
C.a、b、c三點中,c點SO2的轉化率最大
(3)SO2催化氧化是工業生產硫酸的重要步驟,在0.1Mpa、450℃的恒壓容器中測得相關數據如表。
| 起始原料氣體積分數 | 平衡混合氣體積分數 | |
| SO2 | 7% | 0.18% |
| O2 | 11% | 7.86% |
| SO3 | 0% | 7.06% |
| N2 | 82% | 84.9% |
p
2
(
S
O
3
)
P
(
O
2
)
P
2
(
S
O
2
)
(
0
.
1
M
pa
×
7
.
06
%
)
2
0
.
1
M
pa
×
7
.
86
%
×
(
0
.
1
M
pa
×
0
.
18
%
)
2
p
2
(
S
O
3
)
P
(
O
2
)
P
2
(
S
O
2
)
(
0
.
1
M
pa
×
7
.
06
%
)
2
0
.
1
M
pa
×
7
.
86
%
×
(
0
.
1
M
pa
×
0
.
18
%
)
2
增大體系的壓強、降低溫度,及時分離出三氧化硫等
增大體系的壓強、降低溫度,及時分離出三氧化硫等
。(4)Li/SO2電池以LiBr-AN(乙腈)、液態SO2為電解質溶液,放電時有白色的連二亞硫酸鋰(Li2S2O4)沉淀生成。
①放電時的正極反應式為
2SO2+2e-+2Li+=Li2S2O4↓;
2SO2+2e-+2Li+=Li2S2O4↓;
。②該電池比能量高達300Wh/kg(電池的比能量是指單位質量的電極材料能釋放出的最大電能),該電池比能量高的原因是
鋰的相對原子質量為7是所有金屬最小的,所以該電池比能量高
鋰的相對原子質量為7是所有金屬最小的,所以該電池比能量高
。【答案】-41.8kJ/mol;Kb<Ka<Kc;C;=≈1.96×105Mpa-1;增大體系的壓強、降低溫度,及時分離出三氧化硫等;2SO2+2e-+2Li+=Li2S2O4↓;;鋰的相對原子質量為7是所有金屬最小的,所以該電池比能量高
p
2
(
S
O
3
)
P
(
O
2
)
P
2
(
S
O
2
)
(
0
.
1
M
pa
×
7
.
06
%
)
2
0
.
1
M
pa
×
7
.
86
%
×
(
0
.
1
M
pa
×
0
.
18
%
)
2
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:40引用:1難度:0.4
相似題
-
 1.第五主族的磷單質及其化合物在工業上有廣泛應用.
1.第五主族的磷單質及其化合物在工業上有廣泛應用.
(1)同磷灰石在高溫下制備黃磷的熱化學方程式為:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H已知相同條件下:4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H12Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g)△H2SiO2(s)+CaO(s)=CaSiO3(s)△H3用△H1、△H2和△H3表示△H,則△H=;
(2)白磷與氧氣反應生成P4O10固體.已知斷裂下列化學鍵需要吸收的能量分別為:P-P a kJ?mol-1、P-O b kJ?mol-1、P═O c kJ?mol-1、O═O d kJ?mol-1.根據圖1的分子結構和有關數據通過計算寫出該反應的熱化學方程式為.
(3)三聚磷酸可視為三個磷酸分子(磷酸結構式如圖2)之間脫去兩個水分子產物,其結構式為,三聚磷酸鈉(俗稱“五鈉”)是常用的水處理劑,其化學式為.
(4)次磷酸(H3PO2)為一元酸,分子中含一個羥基,其鈉鹽的正鹽的化學式為,該鹽可用于工業上的化學鍍鎳.①化學鍍鎳的溶液中含有Ni2+和H2PO2-,在酸性等條件下發生下述反應:
(a)□Ni2++□H2PO2-+□=□Ni++□H2PO3-+□
(b)6H2PO-2+2H+=2P+4H2PO3-+3H2↑請在答題卡上寫出并配平反應式(a);
②利用①中反應可在塑料鍍件表面沉積鎳-磷合金,從而達到化學鍍鎳的目的,這是一種常見的化學鍍.請從以下方面比較化學鍍與電鍍.原理上的不同點:;化學鍍的優點:.發布:2024/11/19 8:0:1組卷:77引用:2難度:0.1 -
2.氨和聯氨(N2H4)是氮的兩種常見化合物,在科學技術和生產中有重要的應用.聯氨(又稱肼,N2H4或H2N-NH2,無色液體)是一種應用廣泛的化工原料,可用作火箭燃料.回答下列問題:
(1)聯氨分子的電子式為,其中氮的化合價為;
(2)實驗室中可用次氯酸鈉溶液與氨反應制備聯氨,該反應中還原劑與氧化劑的物質的量之比為2:1,反應的化學方程式為.
(3)①2O2(g)+N2(g)═N2O4(g)△H1
②ON2(g)+2H2(g)═N2H4(l)△H2
③O2(g)+2H2(g)═2H2O(g)△H3
④N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H4=-1038.6kJ?mol-1
上述反應熱效應之間的關系式為△H4=,聯氨和N2O4可作為火箭推進劑的主要原因為.
(4)聯氨可用作火箭燃料,燃燒時發生的反應是N2O4(l)+2N2O4(l)═3N2(g)+4H2O(g)△H=-1038.6kJ?mol-1,若該反應中有4molN-H鍵斷裂,則反應放出的熱量為kJ.發布:2024/11/18 8:0:1組卷:12引用:0難度:0.9 -
3.已知在1200℃時,天然氣脫硫工藝中會發生下列反應:
①H2S(g)+O2(g)═SO2(g)+H2O(g) ΔH132
②2H2S(g)+SO2(g)═S2(g)+2H2O(g) ΔH232
③H2S(g)+O2(g)═S(g)+H2O(g) ΔH312
④2S(g)═S2(g) ΔH4
則ΔH4的正確表達式為( )A.ΔH4= (ΔH1+ΔH2-3ΔH3)23B.ΔH4= (3ΔH3-ΔH1-ΔH2)23C.ΔH4= (ΔH1+ΔH2-3ΔH3)32D.ΔH4= (ΔH1-ΔH2-3ΔH3)32發布:2024/12/6 13:30:1組卷:393引用:6難度:0.5
相關試卷


