工業上用含氧化鐵(Fe2O3)80%的赤鐵礦冶煉生鐵。
(1)CO還原氧化鐵得到鐵的化學方程式是 Fe2O3+3CO 高溫 2Fe+3CO2Fe2O3+3CO 高溫 2Fe+3CO2,冶煉含鐵96%的生鐵58.33t至少需要上述赤鐵礦 100.0100.0t。(計算結果精確至0.1)
(2)已知Fe2O3在高爐中有下列中間反應:Fe2O3+CO 高溫 2FeO+CO2。反應形成的固體混合物(Fe2O3、FeO)中,鐵和氧元素的質量比不可能是 adad。
a.21:9
b.21:8
c.21:7
d.21:6
(3)已知Fe2O3和CO的中間反應分兩步進行:3Fe2O3+CO 高溫 2Fe3O4+CO2,Fe3O4+CO 高溫 3FeO+CO2。Fe2O3、Fe3O4、FeO含鐵質量分數按由大到小的順序排列 FeO、Fe3O4、Fe2O3FeO、Fe3O4、Fe2O3;若反應形成的固體混合物組分為Fe3O4和FeO,鐵和氧元素的質量比=21:a,a的取值范圍為 6<a<86<a<8。
高溫
高溫
高溫
高溫
高溫
【考點】含雜質的化學方程式計算;元素質量比的計算.
【答案】Fe2O3+3CO 2Fe+3CO2;100.0;ad;FeO、Fe3O4、Fe2O3;6<a<8
高溫
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:12引用:1難度:0.5
相似題
-
 1.隨著經濟的發展,能源、環境、材料成為人們日益關注的問題:
1.隨著經濟的發展,能源、環境、材料成為人們日益關注的問題:
(1)倡導“低碳”生活,保護環境,下列舉措能達到“低碳”目的是。
A.提倡使用節能燈
B.廣泛使用一次性筷子
C.利用和開發太陽能、風能等能源
D.選擇步行、騎自行車等方式出行
(2)工業上,用一氧化碳還原含有氧化鐵80%的鐵礦石,可以得到560t的鐵,求鐵礦石的質量。(寫出計算過程)
(3)高速鐵路可以加快出行步伐。結合所學化學知識,回答下列問題:
I、圖中標示的物質中為金屬材料的是(填序號),生鐵和鋼的區別是。
Ⅱ、修建鐵路所需的大量鋼鐵是以鐵礦石為主要原料冶煉而得。下列礦石的主要成分屬于氧化物的是(填字母序號)。
A.鋁土礦(主要成分Al2O3)
B.輝銅礦(主要成分Cu2S)
C.菱鐵礦(主要成分FeCO3)
D.磁鐵礦(主要成分Fe3O4)
Ⅲ、高鐵酸鈉(Na2FeO4)是高鐵列車上常用的一種“綠色環保高效”消毒劑。高鐵酸鈉中鐵元素化合價為。發布:2024/11/6 8:0:1組卷:28引用:1難度:0.6 -
2.金屬和金屬化合物的用途廣泛,是初中化學學習的重要內容.
(1)下列關于合金的說法中錯誤的是.
a.合金是混合物
b.合金中不能含非金屬元素
c.生鐵和鋼都屬于合金
d.合金比純金屬應用更廣泛
(2)國家大劇院安裝了近2萬塊鈦合金板,其密度只有鋼的60%.生產金屬鈦可用置換法,即將四氯化鈦與金屬鎂在高溫狀態下發生置換反應,則反應的化學方程式為.
(3)某實驗室廢液缸里的廢液含有CuSO4、ZnSO4、FeSO4,如果將廢液直接排放就會造成水污染,化學小組利用課余時間處理廢液,回收工業原料硫酸鋅和有關金屬.實驗過程如圖1.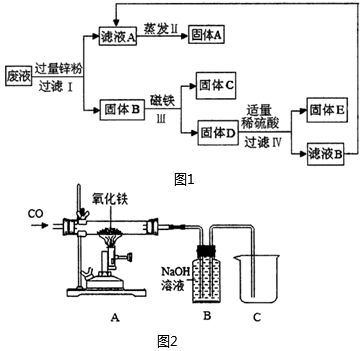
①過濾、蒸發操作中都用到的儀器是;
②固體C的化學式為;
③最終所得硫酸鋅的質量(填“大于”、“小于”或“等于”)原廢液中硫酸鋅質量.
(4)圖2是化學小組設計的工業煉鐵模擬實驗裝置.
①反應結束后,請設計實驗證明裝置B中的溶液還含有NaOH(簡要寫出操作、現象和結論);
②請說明該實驗不需要增加尾氣處理裝置的理由;
③現有2000t含氧化鐵80%的赤鐵礦,可冶煉出多少噸含雜質為4%的生鐵(準確到0.1)?發布:2024/12/31 8:0:1組卷:51引用:1難度:0.5 -
3.現在的鞍鋼集團是世界第三大鋼鐵公司,是涵蓋礦石開采、鋼鐵煉制,鋼鐵加工全產業鏈的大型鋼鐵聯合企業,重組本鋼后,公司有望實現年產粗鋼7000Wt(萬噸),產鐵精礦5000Wt的戰略目標。假設粗鋼中含鐵98%,鐵精礦中Fe2O3含量為90%(其他為不含鐵的雜質)。請計算:
(1)Fe2O3中鐵的質量分數為。(不書寫計算過程,計算結果保留至1%)
(2)現今鞍鋼集團鐵礦石的自給率?(礦石自給率是指企業自產礦石占企業所需礦總量的百分比,請依據化學方程式計算并書寫計算過程,計算結果保留至1%)發布:2024/11/13 23:0:1組卷:96引用:2難度:0.5


