一種從廢舊鋰電池(主要含LiCoO2,及少量Al、Cu)中制備鈷酸鉀(LiCoO2)的工藝流程如圖;
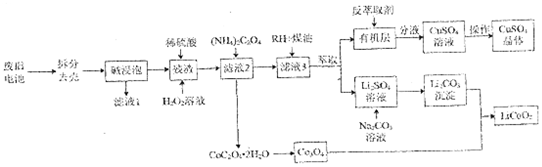
查閱資料:LiCoO2具有很強的氧化性
(1)“堿浸泡”用來除去廢舊電池中的Al,為提高該物質(zhì)的去除率可采取的措施有 適當升溫(或提高堿液濃度、攪拌、粉碎)適當升溫(或提高堿液濃度、攪拌、粉碎)(任寫一條)。
(2)向“殘渣“中加入稀硫酸和 H2O2,寫出LiCoO2參與反應的化學方程式 2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+4H2O+O2↑2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+4H2O+O2↑。
(3)向“濾液2”中加入沉淀劑時,若不采用(NH4)2C2O4而采用Na2C2O4,產(chǎn)物中會混有Co(OH)2,試分析原因 相同條件下,Na2C2O4的堿性更強,溶液中OH-濃度較大,可以與Co2+形成Co(OH)2沉淀相同條件下,Na2C2O4的堿性更強,溶液中OH-濃度較大,可以與Co2+形成Co(OH)2沉淀。
(4)RH蒸取Cu2+的原理可表示為:Cu2++2HR?CuR2+2H+。實驗室進行萃取實驗用到的玻璃儀器是 分液漏斗、燒杯分液漏斗、燒杯;向有機層中加入反萃取劑 H2SO4H2SO4(填化學式)可將Cu2+反萃取至水層。
(5)某CoC2O4?2H2O樣品中可能含有的雜質(zhì)為Co2(C2O4)3、H2C2O4?2H2O,采用KMnO4滴定法測定該樣品的組成,實驗步驟如下:
Ⅰ.取mg樣品于錐形瓶中,加入稀H2SO4溶解,水浴加熱至75℃,用cmol?L-1的KMnO4溶液趁熱滴定至溶液出現(xiàn)粉紅色且30s內(nèi)不褪色,消耗KMnO4溶液V1mL。
Ⅱ.向上述溶液中加入適量還原劑將Co3+完全還原為Co2+,加入稀H2SO4后,在75℃繼續(xù)用cmol?L-1KMnO4溶液滴定至溶液出現(xiàn)粉紅色且30s內(nèi)不褪色,又消耗KMnO4溶液V2mL。
樣品中所含H2C2O4?2H2O(M=126g/mol)的質(zhì)量分數(shù)表達式為 31.5×c(V1-3V2)m%31.5×c(V1-3V2)m%。若盛裝KMnO4溶液的滴定管沒有潤洗,則測得樣品中Co元素含量 偏高偏高。(填“偏高”、“偏低”、“無影響”)
31
.
5
×
c
(
V
1
-
3
V
2
)
m
31
.
5
×
c
(
V
1
-
3
V
2
)
m
【答案】適當升溫(或提高堿液濃度、攪拌、粉碎);2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+4H2O+O2↑;相同條件下,Na2C2O4的堿性更強,溶液中OH-濃度較大,可以與Co2+形成Co(OH)2沉淀;分液漏斗、燒杯;H2SO4;%;偏高
31
.
5
×
c
(
V
1
-
3
V
2
)
m
【解答】
【點評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復制發(fā)布。
發(fā)布:2024/4/20 14:35:0組卷:20引用:1難度:0.5
相似題
-
1.硫鐵礦燒渣是硫鐵礦生產(chǎn)硫酸過程中產(chǎn)生的工業(yè)廢渣(主要含F(xiàn)e2O3及少量SiO2、Al2O3等雜質(zhì))。用該燒渣制取藥用輔料-紅氧化鐵的工藝流程如圖:
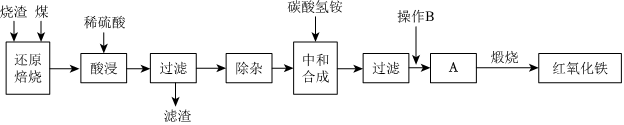
(1)在“還原焙燒”中產(chǎn)生的有毒氣體可能有。
(2)“酸浸”時間一般不超過20min,若在空氣中酸浸時間過長,溶液中Fe2+含量將下降,其原因是(用離子方程式表示)。
(3)“中和合成”的目的是將溶液中Fe2+轉(zhuǎn)變?yōu)樘妓醽嗚F沉淀,則操作B是。
(4)煅燒A的反應方程式是。
(5)ag燒渣經(jīng)過上述工藝可得紅氧化鐵bg。藥典標準規(guī)定,制得的紅氧化鐵中含氧化鐵不得少于98.0%,則所選用的燒渣中鐵的質(zhì)量分數(shù)應不低于(用含a、b的表達式表示)。發(fā)布:2025/1/19 8:0:1組卷:30引用:1難度:0.5 -
2.我國青藏高原的鹽湖中蘊藏著豐富的鋰資源,已探明的儲量約三千萬噸,碳酸鋰制備高純金屬鋰的一種工藝流程如圖。下列有關說法錯誤的是( )
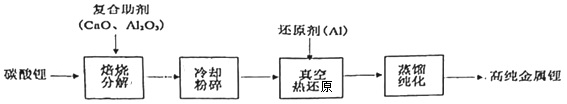
A.金屬鋰可保存在煤油中 B.使用復合助劑有利于碳酸鋰的分解 C.“粉碎”是為了增加接觸面積,加快反應速率 D.真空熱還原發(fā)生的主要化學反應為2Al+3Li2O 6Li+Al2O3高溫發(fā)布:2025/1/6 7:30:5組卷:28引用:2難度:0.9 -
3.查閱資料:CaO、MgO在高溫下與C難反應,但能與SiO2反應.硫鐵礦燒渣是一種工業(yè)廢渣(含F(xiàn)e2O3及少量SiO2、Al2O3、CaO、MgO等雜質(zhì)),該燒渣可用于制取氧化鐵,具體化工生產(chǎn)工藝流程如下:
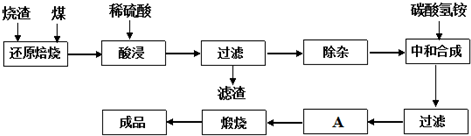
(1)焙燒時產(chǎn)生的主要有害氣體是.
(2)若在空氣中“酸浸”時間過長,溶液中Fe2+含量將下降,其原因是:(用離子方程式表示).
(3)根據(jù)下表數(shù)據(jù):
在“除雜”步驟中,為除去Fe3+和Al3+,溶液的pH最大值應小于氫氧化物 Al(OH)3 Fe(OH)3 Fe(OH)2 開始沉淀的pH 3.10 2.01 7.11 完全沉淀的pH 4.77 3.68 9.61 ,檢驗Fe3+已經(jīng)除盡的試劑是(除KSCN外).
(4)“中和合成”的目的是將溶液中Fe2+轉(zhuǎn)變?yōu)樘妓醽嗚F沉淀,則A的操作是.發(fā)布:2025/1/19 8:0:1組卷:12引用:1難度:0.1


