回答下列問(wèn)題:
(1)在H+、Mg2+、Fe2+、S2-、I-、S中,只有氧化性的是 H+、Mg2+H+、Mg2+,只有還原性的是 S2-、I-S2-、I-。
(2)在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反應(yīng)中,K2Cr2O7K2Cr2O7是氧化劑(用化學(xué)式表示),ClCl元素被氧化(用符號(hào)表示),在反應(yīng)中HCl體現(xiàn) 酸性和還原酸性和還原性。
(3)用單線橋表示反應(yīng)K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O的電子轉(zhuǎn)移方向和數(shù)目。 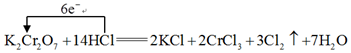
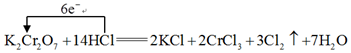 。
。
(4)已知反應(yīng)
①2BrO-3+Cl2=Br2+2ClO-3
②5Cl2+I2+6H2O=12H++2IO-3+10Cl-
③ClO-3+5Cl-+6H+=3Cl2+3H2O,
下列微粒氧化能力強(qiáng)弱順序正確的是 CC。
A.ClO-3>BrO-3>IO-3>Cl2
B.BrO-3>Cl2>ClO-3>IO-3
C.BrO-3>ClO-3>Cl2>IO-3
D.Cl2>BrO-3>ClO-3>IO-3
(5)
①KHSO4在水溶液中的電離方程式:KHSO4=K++H++SO2-4KHSO4=K++H++SO2-4;
②下列物質(zhì)能和KHSO4溶液發(fā)生氧化還原反應(yīng)的有 AA;不能和KHSO4溶液發(fā)生反應(yīng)的有 EE。
A.Zn
B.BaCl2
C.Na2CO3
D.NaOH
E.NaNO3
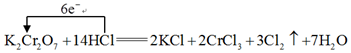
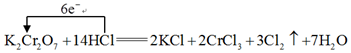
B
r
O
-
3
C
l
O
-
3
IO
-
3
C
l
O
-
3
C
l
O
-
3
B
r
O
-
3
IO
-
3
B
r
O
-
3
C
l
O
-
3
IO
-
3
B
r
O
-
3
C
l
O
-
3
IO
-
3
B
r
O
-
3
C
l
O
-
3
IO
-
3
SO
2
-
4
SO
2
-
4
【考點(diǎn)】氧化性、還原性強(qiáng)弱的比較.
【答案】H+、Mg2+;S2-、I-;K2Cr2O7;Cl;酸性和還原;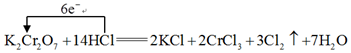 ;C;KHSO4=K++H++;A;E
;C;KHSO4=K++H++;A;E
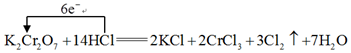 ;C;KHSO4=K++H++
;C;KHSO4=K++H++SO
2
-
4
【解答】
【點(diǎn)評(píng)】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書(shū)面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/4/20 14:35:0組卷:32引用:1難度:0.8
相似題
-
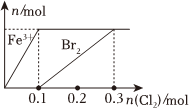 1.向200mLFeBr2溶液中逐漸通入Cl2,其中n(Fe3+)、n(Br2 )隨通入n(Cl2)的變化如圖所示,下列說(shuō)法錯(cuò)誤的是( )
1.向200mLFeBr2溶液中逐漸通入Cl2,其中n(Fe3+)、n(Br2 )隨通入n(Cl2)的變化如圖所示,下列說(shuō)法錯(cuò)誤的是( )A.還原性強(qiáng)弱:Fe2+>Br- B.由圖可知,該FeBr2溶液的濃度為1mol?L-1 C.n(Cl2)=0.12mol時(shí),溶液中的離子濃度有 ═c(Fe3+)c(Br-)59D.氯氣過(guò)量時(shí),反應(yīng)的離子方程式為:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- 發(fā)布:2024/12/7 9:30:1組卷:50引用:3難度:0.5 -
2.根據(jù)反應(yīng)式:①2Fe3++2I-═2Fe2++I2,②Br2+2Fe2+═2Br-+2Fe3+,可判斷離子的還原性從強(qiáng)到弱的順序是( )
A.Br-、Fe2+、I- B.I-、Fe2+、Br- C.Br-、I-、Fe2+ D.Fe2+、I-、Br- 發(fā)布:2024/11/28 12:30:2組卷:346引用:8難度:0.8 -
3.已知:
①2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O;
②Cl2+2FeCl2═2FeCl3;
③2KI+2FeCl3═2KCl+I2+2FeCl2。
則下列判斷正確的是( )A.氧化性:MnO4->Fe3+>Cl2>I2 B.還原性:Cl->I->Fe2+ C.Fe3+只有氧化性,F(xiàn)e2+只有還原性 D.由信息推測(cè):Cl2+2I-═2Cl-+I2反應(yīng)可以進(jìn)行 發(fā)布:2024/12/11 14:0:2組卷:421引用:7難度:0.4


