酸堿鹽均為重要的化合物。
(1)濃硫酸和濃鹽酸敞口放置均會變稀,這是為什么?
(2)稀釋濃硫酸時,切不可把水倒入濃硫酸里,請解釋原因。
(3)向盛有氫氧化鈉溶液(滴有酚酞溶液)的燒杯中滴加鹽酸時,觀察到燒杯中的溶液有紅色變?yōu)闊o色。燒杯中無色溶液的溶質(zhì)可能只有NaCl,也可能還有HCl.要確定該溶質(zhì)的成分,請寫出一種可選用的試劑。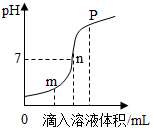
(4)氫氧化鈉和鹽酸能發(fā)生反應(yīng),從微觀角度分析,該反應(yīng)的實(shí)質(zhì)是氫離子和氫氧根離子結(jié)合生成水分子氫離子和氫氧根離子結(jié)合生成水分子
(5)鹽酸與氫氧化鈉溶液反應(yīng)時溶液pH的變化如圖所示。
下列說法正確的是cc。
a.m點(diǎn)所示溶液為堿性
b.n點(diǎn)所示溶液中加紫色石蕊溶液顯紅色
c.p點(diǎn)所示溶液中溶質(zhì)為NaCl和NaOH
d.該圖所對應(yīng)操作是將鹽酸滴入氫氧化鈉溶液中
(6)工業(yè)上,常用電解氯化鈉溶液的方法制取氫氧化鈉,同時還能獲得氫氣、氯氣兩種化工產(chǎn)品,其反應(yīng)的化學(xué)方程式為2NaCl+2H2O 通電 2NaOH+Cl2↑+H2↑2NaCl+2H2O 通電 2NaOH+Cl2↑+H2↑。
(7)40克10%的鹽酸和40克10%氫氧化鈉溶液混合反應(yīng)后,所得溶液的pH<<7
(8)若73克質(zhì)量分?jǐn)?shù)為10%的鹽酸與127克氫氧化鈉溶液恰好完全反應(yīng),試計(jì)算反應(yīng)后所得溶液中溶質(zhì)的質(zhì)量分?jǐn)?shù)。
通電
通電
【考點(diǎn)】根據(jù)化學(xué)反應(yīng)方程式的計(jì)算;濃硫酸的性質(zhì)及濃硫酸的稀釋;有關(guān)溶質(zhì)質(zhì)量分?jǐn)?shù)的簡單計(jì)算;酸的物理性質(zhì)及用途;中和反應(yīng)及其應(yīng)用;溶液的酸堿性與pH的關(guān)系.
【答案】氫離子和氫氧根離子結(jié)合生成水分子;c;2NaCl+2H2O 2NaOH+Cl2↑+H2↑;<
通電
【解答】
【點(diǎn)評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/4/20 14:35:0組卷:35引用:1難度:0.3
相似題
-
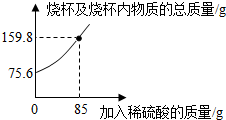 1.為測定某碳素鋼樣品中鐵的質(zhì)量分?jǐn)?shù),現(xiàn)取一定質(zhì)量的樣品粉末于質(zhì)量為52.2g的燒杯中,然后緩慢加入一定質(zhì)量的稀硫酸,當(dāng)加稀硫酸質(zhì)量為85g時,反應(yīng)恰好完全(雜質(zhì)不反應(yīng)且產(chǎn)生的氣體全部逸出),反應(yīng)過程中的質(zhì)量關(guān)系如圖.完成下列問題:
1.為測定某碳素鋼樣品中鐵的質(zhì)量分?jǐn)?shù),現(xiàn)取一定質(zhì)量的樣品粉末于質(zhì)量為52.2g的燒杯中,然后緩慢加入一定質(zhì)量的稀硫酸,當(dāng)加稀硫酸質(zhì)量為85g時,反應(yīng)恰好完全(雜質(zhì)不反應(yīng)且產(chǎn)生的氣體全部逸出),反應(yīng)過程中的質(zhì)量關(guān)系如圖.完成下列問題:
(1)該實(shí)驗(yàn)取用的樣品質(zhì)量為g.
(2)計(jì)算樣品中鐵的質(zhì)量分?jǐn)?shù)(寫出解題過程).發(fā)布:2025/1/9 8:0:2組卷:139引用:39難度:0.1 -
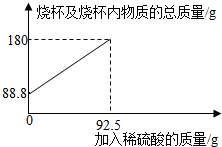 2.為測定某碳素鋼樣品中鐵的質(zhì)量分?jǐn)?shù),現(xiàn)取一定質(zhì)量的樣品粉末于質(zhì)量為51.8克的燒杯中,然后逐步加入一定質(zhì)量分?jǐn)?shù)的稀硫酸,當(dāng)加入92.5g稀硫酸時恰好完全反應(yīng),加入稀硫酸的質(zhì)量與燒杯及燒杯內(nèi)物質(zhì)的總質(zhì)量的關(guān)系如圖。
2.為測定某碳素鋼樣品中鐵的質(zhì)量分?jǐn)?shù),現(xiàn)取一定質(zhì)量的樣品粉末于質(zhì)量為51.8克的燒杯中,然后逐步加入一定質(zhì)量分?jǐn)?shù)的稀硫酸,當(dāng)加入92.5g稀硫酸時恰好完全反應(yīng),加入稀硫酸的質(zhì)量與燒杯及燒杯內(nèi)物質(zhì)的總質(zhì)量的關(guān)系如圖。
(1)該實(shí)驗(yàn)取用的樣品質(zhì)量為g。
(2)反應(yīng)后所得溶液中的溶質(zhì)的質(zhì)量分?jǐn)?shù)。(寫出計(jì)算過程,結(jié)果保留一位小數(shù))
(3)反應(yīng)結(jié)束后,小明不慎向燒杯中多加了10g稀硫酸,若在圖中補(bǔ)繪此過程中稀硫酸的質(zhì)量與燒杯及燒杯內(nèi)物質(zhì)的總質(zhì)量的關(guān)系圖,所得線段的終點(diǎn)位于線段AB延長線的(填:上方、下方或線上)。發(fā)布:2025/1/9 8:0:2組卷:4引用:1難度:0.3 -
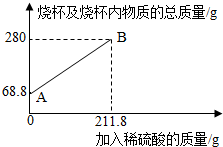 3.為測定某碳素鋼樣品中鐵的質(zhì)量分?jǐn)?shù),現(xiàn)取一定質(zhì)量的樣品粉末于質(zhì)量為51.8克的燒杯中,然后逐步加入一定質(zhì)量分?jǐn)?shù)的稀硫酸,當(dāng)加入211.8g稀硫酸時恰好完全反應(yīng),加入稀硫酸的質(zhì)量與燒杯及燒杯內(nèi)物質(zhì)的總質(zhì)量的關(guān)系如圖。
3.為測定某碳素鋼樣品中鐵的質(zhì)量分?jǐn)?shù),現(xiàn)取一定質(zhì)量的樣品粉末于質(zhì)量為51.8克的燒杯中,然后逐步加入一定質(zhì)量分?jǐn)?shù)的稀硫酸,當(dāng)加入211.8g稀硫酸時恰好完全反應(yīng),加入稀硫酸的質(zhì)量與燒杯及燒杯內(nèi)物質(zhì)的總質(zhì)量的關(guān)系如圖。
(1)該實(shí)驗(yàn)取用的樣品質(zhì)量為g。
(2)求樣品中鐵的質(zhì)量分?jǐn)?shù);反應(yīng)后所得溶液中的溶質(zhì)的質(zhì)量分?jǐn)?shù)。(寫出計(jì)算過程,結(jié)果保留一位小數(shù))
(3)反應(yīng)結(jié)束后,小明不慎向燒杯中多加了20g稀硫酸,若在圖中補(bǔ)繪此過程中稀硫酸的質(zhì)量與燒杯及燒杯內(nèi)物質(zhì)的總質(zhì)量的關(guān)系圖,所得線段的終點(diǎn)位于線段AB延長線的(填:上方、下方或線上)。發(fā)布:2025/1/9 8:0:2組卷:8引用:1難度:0.3


