為確定15.8g高錳酸鉀完全分解能產生氧氣的質量,小柯與小妍兩位同學采用方法如下,根據他們測試方法,回答及計算:
| 小柯:實驗測定法 | 小妍:計算法 |
| 在老師指導下,將15.8g高錳酸鉀高錳酸鉀充分加熱,得到氧氣1120mL | 解:高錳酸鉀中氧元素的質量分數: 氧的相對原子質量 × 4 高錳酸鉀的相對分子質量 = 16 × 4 39 + 55 + 16 × 4 氧氣的質量為:15.8g×40.5%=6.4g 答:15.8g高錳酸鉀完全分解產生氧氣6.4g |
B
B
。A.高錳酸鉀中含氧元素
B.錳酸鉀和二氧化錳中含氧元素
C.氧氣中含氧元素
(2)已知:在小柯的實驗條件下,氧氣的密度為1.429g/L,求算小柯得到的氧氣的質量(結果保留一位小數)。
(3)計算15.8g高錳酸鉀完全分解產生的氧氣的質量(要求有解題過程)。
【考點】根據化學反應方程式的計算.
【答案】B
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/8/9 8:0:9組卷:87引用:3難度:0.5
相似題
-
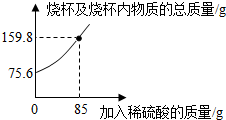 1.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為52.2g的燒杯中,然后緩慢加入一定質量的稀硫酸,當加稀硫酸質量為85g時,反應恰好完全(雜質不反應且產生的氣體全部逸出),反應過程中的質量關系如圖.完成下列問題:
1.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為52.2g的燒杯中,然后緩慢加入一定質量的稀硫酸,當加稀硫酸質量為85g時,反應恰好完全(雜質不反應且產生的氣體全部逸出),反應過程中的質量關系如圖.完成下列問題:
(1)該實驗取用的樣品質量為g.
(2)計算樣品中鐵的質量分數(寫出解題過程).發布:2025/1/9 8:0:2組卷:139引用:39難度:0.1 -
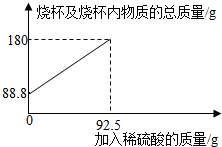 2.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為51.8克的燒杯中,然后逐步加入一定質量分數的稀硫酸,當加入92.5g稀硫酸時恰好完全反應,加入稀硫酸的質量與燒杯及燒杯內物質的總質量的關系如圖。
2.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為51.8克的燒杯中,然后逐步加入一定質量分數的稀硫酸,當加入92.5g稀硫酸時恰好完全反應,加入稀硫酸的質量與燒杯及燒杯內物質的總質量的關系如圖。
(1)該實驗取用的樣品質量為g。
(2)反應后所得溶液中的溶質的質量分數。(寫出計算過程,結果保留一位小數)
(3)反應結束后,小明不慎向燒杯中多加了10g稀硫酸,若在圖中補繪此過程中稀硫酸的質量與燒杯及燒杯內物質的總質量的關系圖,所得線段的終點位于線段AB延長線的(填:上方、下方或線上)。發布:2025/1/9 8:0:2組卷:4引用:1難度:0.3 -
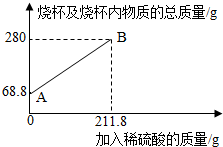 3.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為51.8克的燒杯中,然后逐步加入一定質量分數的稀硫酸,當加入211.8g稀硫酸時恰好完全反應,加入稀硫酸的質量與燒杯及燒杯內物質的總質量的關系如圖。
3.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為51.8克的燒杯中,然后逐步加入一定質量分數的稀硫酸,當加入211.8g稀硫酸時恰好完全反應,加入稀硫酸的質量與燒杯及燒杯內物質的總質量的關系如圖。
(1)該實驗取用的樣品質量為g。
(2)求樣品中鐵的質量分數;反應后所得溶液中的溶質的質量分數。(寫出計算過程,結果保留一位小數)
(3)反應結束后,小明不慎向燒杯中多加了20g稀硫酸,若在圖中補繪此過程中稀硫酸的質量與燒杯及燒杯內物質的總質量的關系圖,所得線段的終點位于線段AB延長線的(填:上方、下方或線上)。發布:2025/1/9 8:0:2組卷:8引用:1難度:0.3


