為測(cè)定某品牌蘇打餅干中碳酸鈉的質(zhì)量分?jǐn)?shù)(餅干中其他成分不與稀鹽酸反應(yīng)),同學(xué)們?nèi)?0g樣品研碎后放入燒杯,加入適量蒸餾水充分?jǐn)嚢琛⑦^濾、洗滌后,將濾液和洗滌液合并后倒入容器A中并進(jìn)行了如下實(shí)驗(yàn):

(1)上述步驟中將濾液和洗滌液合并的原因是 確保樣品的碳酸鈉不損失,全部參與反應(yīng)確保樣品的碳酸鈉不損失,全部參與反應(yīng);
(2)Ⅱ中堿石灰的作用為防止空氣中的 水和二氧化碳水和二氧化碳進(jìn)入,對(duì)實(shí)驗(yàn)造成干擾;
(3)打開止水夾,向裝置中通入一段時(shí)間N2后,關(guān)閉止水夾,稱量干燥管Ⅰ的質(zhì)量為m1;逐滴加入稀鹽酸至不再產(chǎn)生氣泡時(shí)后打開止水夾,通入一段N2,關(guān)閉止水夾,稱量干燥管Ⅰ的質(zhì)量為m2。實(shí)驗(yàn)測(cè)得m2-m1=0.088g,同學(xué)們做了如下的計(jì)算,請(qǐng)你補(bǔ)充完整:
解:設(shè)樣品中碳酸鈉的質(zhì)量為x。
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 0.088g
列出比例式:10644=x0.088g10644=x0.088gx=0.212g
答:樣品中碳酸鈉的質(zhì)量分?jǐn)?shù)為 0.212g50g×100%=0.424%0.212g50g×100%=0.424%(列式并計(jì)算)。
(4)若滴加鹽酸后沒有繼續(xù)通入氮?dú)猓瑫?huì)使結(jié)果 偏小偏小(填“偏大”、“不變”、“偏小”);
(5)實(shí)驗(yàn)后若要證明A中殘留液體中鹽酸過量,可以采取的實(shí)驗(yàn)操作是 向A中殘留液體中加入鋅粉,若有氣泡產(chǎn)生,則證明鹽酸過量向A中殘留液體中加入鋅粉,若有氣泡產(chǎn)生,則證明鹽酸過量。
106
44
=
x
0
.
088
g
106
44
=
x
0
.
088
g
0
.
212
g
50
g
0
.
212
g
50
g
【考點(diǎn)】根據(jù)化學(xué)反應(yīng)方程式的計(jì)算;鹽的化學(xué)性質(zhì).
【答案】確保樣品的碳酸鈉不損失,全部參與反應(yīng);水和二氧化碳;;×100%=0.424%;偏小;向A中殘留液體中加入鋅粉,若有氣泡產(chǎn)生,則證明鹽酸過量
106
44
=
x
0
.
088
g
0
.
212
g
50
g
【解答】
【點(diǎn)評(píng)】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:29引用:1難度:0.3
相似題
-
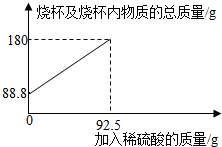 1.為測(cè)定某碳素鋼樣品中鐵的質(zhì)量分?jǐn)?shù),現(xiàn)取一定質(zhì)量的樣品粉末于質(zhì)量為51.8克的燒杯中,然后逐步加入一定質(zhì)量分?jǐn)?shù)的稀硫酸,當(dāng)加入92.5g稀硫酸時(shí)恰好完全反應(yīng),加入稀硫酸的質(zhì)量與燒杯及燒杯內(nèi)物質(zhì)的總質(zhì)量的關(guān)系如圖。
1.為測(cè)定某碳素鋼樣品中鐵的質(zhì)量分?jǐn)?shù),現(xiàn)取一定質(zhì)量的樣品粉末于質(zhì)量為51.8克的燒杯中,然后逐步加入一定質(zhì)量分?jǐn)?shù)的稀硫酸,當(dāng)加入92.5g稀硫酸時(shí)恰好完全反應(yīng),加入稀硫酸的質(zhì)量與燒杯及燒杯內(nèi)物質(zhì)的總質(zhì)量的關(guān)系如圖。
(1)該實(shí)驗(yàn)取用的樣品質(zhì)量為g。
(2)反應(yīng)后所得溶液中的溶質(zhì)的質(zhì)量分?jǐn)?shù)。(寫出計(jì)算過程,結(jié)果保留一位小數(shù))
(3)反應(yīng)結(jié)束后,小明不慎向燒杯中多加了10g稀硫酸,若在圖中補(bǔ)繪此過程中稀硫酸的質(zhì)量與燒杯及燒杯內(nèi)物質(zhì)的總質(zhì)量的關(guān)系圖,所得線段的終點(diǎn)位于線段AB延長(zhǎng)線的(填:上方、下方或線上)。發(fā)布:2025/1/9 8:0:2組卷:4引用:1難度:0.3 -
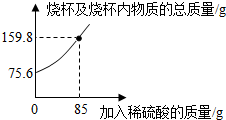 2.為測(cè)定某碳素鋼樣品中鐵的質(zhì)量分?jǐn)?shù),現(xiàn)取一定質(zhì)量的樣品粉末于質(zhì)量為52.2g的燒杯中,然后緩慢加入一定質(zhì)量的稀硫酸,當(dāng)加稀硫酸質(zhì)量為85g時(shí),反應(yīng)恰好完全(雜質(zhì)不反應(yīng)且產(chǎn)生的氣體全部逸出),反應(yīng)過程中的質(zhì)量關(guān)系如圖.完成下列問題:
2.為測(cè)定某碳素鋼樣品中鐵的質(zhì)量分?jǐn)?shù),現(xiàn)取一定質(zhì)量的樣品粉末于質(zhì)量為52.2g的燒杯中,然后緩慢加入一定質(zhì)量的稀硫酸,當(dāng)加稀硫酸質(zhì)量為85g時(shí),反應(yīng)恰好完全(雜質(zhì)不反應(yīng)且產(chǎn)生的氣體全部逸出),反應(yīng)過程中的質(zhì)量關(guān)系如圖.完成下列問題:
(1)該實(shí)驗(yàn)取用的樣品質(zhì)量為g.
(2)計(jì)算樣品中鐵的質(zhì)量分?jǐn)?shù)(寫出解題過程).發(fā)布:2025/1/9 8:0:2組卷:139引用:39難度:0.1 -
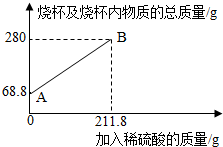 3.為測(cè)定某碳素鋼樣品中鐵的質(zhì)量分?jǐn)?shù),現(xiàn)取一定質(zhì)量的樣品粉末于質(zhì)量為51.8克的燒杯中,然后逐步加入一定質(zhì)量分?jǐn)?shù)的稀硫酸,當(dāng)加入211.8g稀硫酸時(shí)恰好完全反應(yīng),加入稀硫酸的質(zhì)量與燒杯及燒杯內(nèi)物質(zhì)的總質(zhì)量的關(guān)系如圖。
3.為測(cè)定某碳素鋼樣品中鐵的質(zhì)量分?jǐn)?shù),現(xiàn)取一定質(zhì)量的樣品粉末于質(zhì)量為51.8克的燒杯中,然后逐步加入一定質(zhì)量分?jǐn)?shù)的稀硫酸,當(dāng)加入211.8g稀硫酸時(shí)恰好完全反應(yīng),加入稀硫酸的質(zhì)量與燒杯及燒杯內(nèi)物質(zhì)的總質(zhì)量的關(guān)系如圖。
(1)該實(shí)驗(yàn)取用的樣品質(zhì)量為g。
(2)求樣品中鐵的質(zhì)量分?jǐn)?shù);反應(yīng)后所得溶液中的溶質(zhì)的質(zhì)量分?jǐn)?shù)。(寫出計(jì)算過程,結(jié)果保留一位小數(shù))
(3)反應(yīng)結(jié)束后,小明不慎向燒杯中多加了20g稀硫酸,若在圖中補(bǔ)繪此過程中稀硫酸的質(zhì)量與燒杯及燒杯內(nèi)物質(zhì)的總質(zhì)量的關(guān)系圖,所得線段的終點(diǎn)位于線段AB延長(zhǎng)線的(填:上方、下方或線上)。發(fā)布:2025/1/9 8:0:2組卷:8引用:1難度:0.3
相關(guān)試卷


