根據元素周期表1~20號元素的性質和遞變規律,回答下列問題.
(1)屬于金屬元素的有77種,金屬性最強的元素與氧反應生成的化合物為K2O、KO2、K2O2K2O、KO2、K2O2(填兩種化合物的化學式);
(2)屬于稀有氣體的是He、Ne、ArHe、Ne、Ar(填元素符號,下同);
(3)形成化合物種類最多的兩種元素是C、HC、H;
(4)第三周期中,原子半徑最大的是(稀有氣體除外)NaNa;
(5)推測Si、N最簡單氫化物的穩定性:NH3NH3強于SiH4SiH4(填化學式).
(6)電負性最大的元素是FF,電負性最小的元素是KK.
(7)原子中p軌道半充滿的元素是N、PN、P.
【考點】元素周期律和元素周期表的綜合應用.
【答案】7;K2O、KO2、K2O2;He、Ne、Ar;C、H;Na;NH3;SiH4;F;K;N、P
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:67引用:4難度:0.9
相似題
-
 1.下表是元素周期表的一部分.表中所列的字母分別代表一種化學元素.
1.下表是元素周期表的一部分.表中所列的字母分別代表一種化學元素.
(1)元素a和元素b的簡單氫化物熔點較高的是a b c d e f (用化學式填空),其原因是.
(2)a和d可形成不同晶體,下列說法正確的是(NA是阿伏加德羅常數).
A.元素a的單質可能是原子晶體或分子晶體
B.mg d元素形成的晶體中,含共價鍵數目為m NA/7
C.元素a與元素d形成的化合物40g,含NA個分子
D.元素d的最高價氧化物6g,含共價鍵物質的量為0.4mol
(3)c和e形成的化合物的中,每個陽離子周圍距離最近且等距離的陽離子有個,一個晶胞中的陰離子數目為個.晶體中陽離子和陰離子核間距為a cm,該化合物相對分子質量為M,NA為阿伏加德羅常數,則晶體密度為g/cm3.
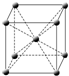
(4)f原子的外圍電子排布式為,其晶胞結構如圖,f單質的晶體密度為ρg/cm3,f相對原子質量為M,阿伏加德羅常數NA,則f的原子半徑為.發布:2025/1/18 8:0:1組卷:8引用:1難度:0.3 -
2.如圖為元素周期表短周期的一部分,下列有關A、B、C、D四種元素的敘述正確的是( )

A.原子半徑大小為:B>A>C B.核電荷數:D>C>B>A C.A與D形成的化合物均是離子鍵 D.生成的氫化物的穩定性為:D>A>B 發布:2024/12/30 18:30:1組卷:8引用:3難度:0.7 -
3.甲~庚等元素在周期表中的相對位置如圖,己的最高氧化物對應水化物有強脫水性,甲和丁在同一周期,甲原子最外層與最內層具有相同電子數.下列判斷正確的是( )
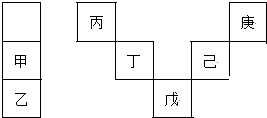
A.丁用于制造光導纖維 B.氣態氫化物的穩定性:庚<己<戊 C.常溫下,甲和乙的單質均能與水劇烈反應 D.丙與戊的原子序數相差28 發布:2024/12/30 19:30:2組卷:50引用:5難度:0.7


