青蒿素是我國科學家從傳統中藥中發現的能治療瘧疾的有機化合物。已知:青蒿素是烴的含氧衍生物,為無色針狀晶體,可溶于乙醇、乙醚,在水中幾乎不溶,熔點為156~157℃,熱穩定性差,青蒿素60℃以上易分解。從青蒿中提取青蒿素的方法之一是以萃取原理為基礎的。
(1)從青蒿中提取青蒿素的流程如圖:
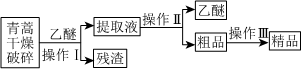
研究團隊經歷了使用不同溶劑和不同溫度的探究過程,實驗結果如下:
| 溶劑 | 水 | 乙醇 | 乙醚 |
| 沸點/℃ | 100 | 78 | 34.5 |
| 提取效率 | 幾乎為0 | 35% | 95% |
過濾
過濾
;操作Ⅱ的名稱是 蒸餾
蒸餾
。②提取青蒿素使用的溶劑最好選擇
乙醚
乙醚
。③研究發現,青蒿素分子中的某個基團受熱不穩定,據此分析用乙醇作溶劑,提取效率偏低,不能達到理想效果的原因是
乙醇沸點相對乙醚來說較高,分離時易造成青蒿素受熱被破壞,導致其提取效率偏低
乙醇沸點相對乙醚來說較高,分離時易造成青蒿素受熱被破壞,導致其提取效率偏低
。④操作Ⅲ的主要過程可能是
B
B
(填字母)。A.加水溶解,蒸發濃縮、冷卻結晶
B.加95%的乙醇,濃縮、結晶、過濾
C.加入乙醚進行萃取分液
(2)某學生對青蒿素的性質進行探究。將青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量較小,加熱并攪拌,青蒿素的溶解量增大,且溶液紅色變淺,說明青蒿素與
C
C
(填字母)具有相似的性質。A.乙醇
B.乙酸
C.乙酸乙酯
D.葡萄糖
(3)青蒿素的質譜數據中有一個峰值與另一種抗瘧藥鷹爪素相同,而鷹爪素的該質譜峰對應過氧基團,于是推測青蒿素中也含有過氧基團,請寫出過氧基的電子式:


分子
分子
晶體。(4)研究還發現,將青蒿素通過下面反應轉化為雙氫青蒿素,治療瘧疾的效果更好。
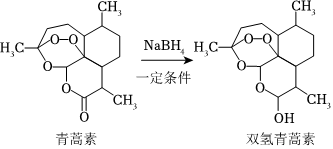
該反應的反應類型是
還原
還原
反應。(5)
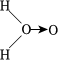 科學家對H2O2分子結構的認識經歷了較為漫長的過程,最初科學家提出了兩種觀點:
科學家對H2O2分子結構的認識經歷了較為漫長的過程,最初科學家提出了兩種觀點:甲:、乙:H-O-O-H,甲式中O→O表示配位鍵,在化學反應中O→O鍵遇到還原劑時易斷裂。化學家Baeyer和Villiyer為研究H2O2的分子結構,設計并完成了下列實驗:
a.將C2H5OH與濃H2SO4反應生成(C2H5)2SO4和水;
b.將制得的(C2H5)2SO4與H2O2反應,只生成A和H2SO4;c.將生成的A與H2反應(已知該反應中H2作還原劑)。
①如果H2O2的結構如甲所示,實驗c中化學反應方程式為(A寫結構簡式)
 +H2→C2H5OC2H5+H2O
+H2→C2H5OC2H5+H2O +H2→C2H5OC2H5+H2O
+H2→C2H5OC2H5+H2O②為了進一步確定H2O2的結構,還需要在實驗c后添加一步實驗d,請設計d的實驗方案:
用無水硫酸銅檢驗c的反應產物中有沒有水
用無水硫酸銅檢驗c的反應產物中有沒有水
。【考點】物質分離、提純的實驗方案設計;有機物的結構和性質.
【答案】過濾;蒸餾;乙醚;乙醇沸點相對乙醚來說較高,分離時易造成青蒿素受熱被破壞,導致其提取效率偏低;B;C; ;分子;還原;
;分子;還原; +H2→C2H5OC2H5+H2O;用無水硫酸銅檢驗c的反應產物中有沒有水
+H2→C2H5OC2H5+H2O;用無水硫酸銅檢驗c的反應產物中有沒有水
 ;分子;還原;
;分子;還原; +H2→C2H5OC2H5+H2O;用無水硫酸銅檢驗c的反應產物中有沒有水
+H2→C2H5OC2H5+H2O;用無水硫酸銅檢驗c的反應產物中有沒有水【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:12引用:2難度:0.6
相似題
-
1.分離乙酸乙酯、乙醇、乙酸的混合物,可按下列步驟進行:
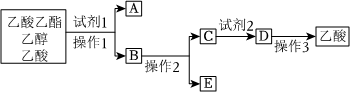
(1)試劑1最好選用。
(2)操作1是,所用的主要儀器名稱是。
(3)操作2是。
(4)試劑2最好選用。
(5)有同學認為乙酸在溫度低于16.6℃時會凝結成晶體,因此可通過降溫的方法使乙酸結晶而分離出來,操作3是結晶、過濾,這一看法是否正確?為什么?發布:2024/12/30 14:30:1組卷:14引用:5難度:0.4 -
2.化學家從反應C2H6(g)+Cl2(g)→C2H5Cl(l)+HCl(g)中受到啟發,提出在農藥和有機合成工業中可獲得副產品鹽酸,這一設想已成為現實.試指出從上述反應體系中得到鹽酸可采用的分離方法是( )
A.蒸餾法 B.水洗法 C.分液法 D.過濾法 發布:2024/12/30 9:30:2組卷:25引用:3難度:0.9 -
3.苯甲酸的重結晶實驗基本操作如下:
①將粗苯甲酸1g加到100mL的燒杯中,再加入50mL蒸餾水,在石棉網上邊攪拌邊加熱,使粗苯甲酸溶解,②全溶后再加入少量蒸餾水并攪拌.③然后,使用短頸玻璃漏斗趁熱將溶液過濾到另一100mL燒杯中,將濾液靜置,使其緩慢冷卻結晶.④濾出晶體.回答下列問題:
(1)上述四步操作過程中需用到玻璃棒的步驟有
(2)步驟②的目的是;
(3)觀察濾液冷卻時的實驗現象:;
(4)重結晶后苯甲酸的狀態:.發布:2024/12/30 8:30:1組卷:45引用:4難度:0.5


