①某100mL的CuCl2溶液中,已知溶液中的Cl-的濃度為0.2 mol?L-1。現將一定量的鐵粉投入到該溶液中,回答下列問題:
(1)原溶液中Cu2+的濃度為0.1mol?L-10.1mol?L-1。
(2)反應后測得Cl-的濃度為0.2mol/L0.2mol/L。
(3)若反應后測得Fe2+的溶液為0.05mol?L-1,則反應生成銅單質的質量是多少,請寫出詳細的計算過程n(Fe2+)=0.1L×0.05mol/L=0.005mol,由Cu2++Fe=Fe2++Cu,可知參加反應Fe等于生成Cu的物質的量,n(Cu)=0.005mol,故生成Cu的質量為0.005mol×64g/mol=0.32gn(Fe2+)=0.1L×0.05mol/L=0.005mol,由Cu2++Fe=Fe2++Cu,可知參加反應Fe等于生成Cu的物質的量,n(Cu)=0.005mol,故生成Cu的質量為0.005mol×64g/mol=0.32g。
②已知Fe2O3在高爐中有下列反應:Fe2O3+CO═2FeO+CO2。反應形成的固體混合物(Fe2O3、FeO)中,元素鐵和氧的質量比用m (Fe):m(O)表示:
(1)上述固體混合物中,m(Fe):m(O)不可能是ADAD。
A.21:9
B.21:8
C.21:7.5
D.21:4
(2)若m(Fe):m(O)=3:1,計算Fe2O3與FeO的物質的量之比1:41:4,Fe2O3被CO還原的百分率66.7%66.7%。
【答案】0.1mol?L-1;0.2mol/L;n(Fe2+)=0.1L×0.05mol/L=0.005mol,由Cu2++Fe=Fe2++Cu,可知參加反應Fe等于生成Cu的物質的量,n(Cu)=0.005mol,故生成Cu的質量為0.005mol×64g/mol=0.32g;AD;1:4;66.7%
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/5/23 20:38:36組卷:20引用:1難度:0.5
相似題
-
1.用25mL 18.4mol/L的濃硫酸與銅共熱一段時間后,冷卻,過濾除去多余的銅,將濾液稀釋到100mL,所得溶液中
濃度為3mol/L,則此時溶液中CuSO4的物質的量濃度為( )SO2-4A.0.5mol/L B.1.6 mol/L C.1.8 mol/L D.3mol/L 發布:2024/12/30 4:0:1組卷:138引用:6難度:0.5 -
2.標準狀況下,將一充滿HCl氣體的燒瓶倒扣在盛有水的水槽中,HCl氣體被完全吸收,假設溶液沒有損失,則燒瓶內所得溶液的物質的量濃度為( )
A.0.045 mol/L B.1 mol/L C.0.5 mol/L D.2.24mol/L 發布:2024/12/30 6:0:2組卷:17引用:3難度:0.7 -
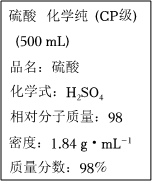 3.如圖是硫酸試劑標簽上的部分內容,據此下列說法正確的是( )
3.如圖是硫酸試劑標簽上的部分內容,據此下列說法正確的是( )A.該硫酸試劑的物質的量濃度為18.4mol?L-1 B.該硫酸可以干燥H2S等酸性氣體,但不可以干燥NH3 C.50mL該H2SO4中加入足量的銅片并加熱,被還原的H2SO4的物質的量為0.46mol D.2.7g Al與足量的該硫酸反應可得到H23.36L 發布:2024/12/30 4:30:1組卷:79引用:3難度:0.8


