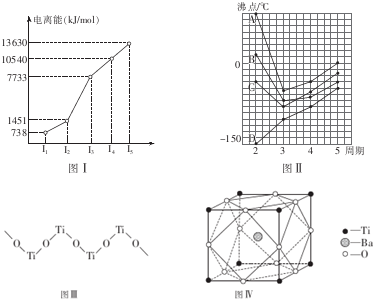
(1)某短周期金屬元素R的部分電離能情況如圖Ⅰ表示,則R元素位于周期表第 ⅡAⅡA族,其基態原子的電子排布式是 1s22s22p63s21s22s22p63s2.圖Ⅱ中A、B、C、D是四種不同主族元素的氣態氫化物,其中A比B分子沸點高的可能原因是 H2O分子之間形成的氫鍵數目比HF分子之間多H2O分子之間形成的氫鍵數目比HF分子之間多.
(2)圖Ⅱ中C物質能與很多化合物通過配位鍵發生相互作用.例如:C與第2周期中的另一種元素的氫化物相互作用得到的化合物X是科學家潛心研究的一種儲氫材料,X是乙烷的等電子體;加熱X會緩慢釋放H2,轉變為化合物Y,Y是乙烯的等電子體.
①化合物C的分子空間構型為 三角錐型三角錐型,X的結構式為 
 (必須標明配位鍵).
(必須標明配位鍵).
②形成C物質的中心原子在X、Y分子中的雜化方式分別是 sp3和sp2sp3和sp2,Y分子中σ鍵和π鍵數目之比為 5:15:1.(3)過渡金屬鈦有“生物金屬”之稱,其化合物以+4價穩定.回答下列問題:
①工業上通過蒸餾還原TiCl4制得單質鈦.常溫下TiCl4是一種有刺激性臭味的無色液體,熔點-23.2℃,沸點136.2℃,推斷TiCl4屬于 分子分子晶體
②Ti3+可以形成兩種不同的配合物:[Ti( H2O)6]Cl3(紫色),[TiCl(H2O)5]Cl2?H2O(綠色),兩者配位數 相同相同(填“相同”或“不同”),綠色晶體中配體是 Cl-、H2OCl-、H2O.
③TiO2難溶于水和稀酸,但能溶于濃硫酸,析出含有鈦酰離子的晶體,鈦酰離子常成為鏈狀聚合形式的陽離子,其結構形式如圖Ⅲ,化學式為 [TiO]n2n+[TiO]n2n+.
④TiO2與BaCO3一起熔融可制得偏鈦酸鋇,該物質熱穩定性好,介電常數高,是制造大容量電容器的極好材料,該晶體胞的結構示意圖如圖Ⅳ.請寫出制備偏鈦酸鋇的化學方程式 TiO2+BaCO3 高溫 BaTiO3+CO2↑TiO2+BaCO3 高溫 BaTiO3+CO2↑.


高溫
高溫
【答案】ⅡA;1s22s22p63s2;H2O分子之間形成的氫鍵數目比HF分子之間多;三角錐型; ;sp3和sp2;5:1;分子;相同;Cl-、H2O;[TiO]n2n+;TiO2+BaCO3 BaTiO3+CO2↑
;sp3和sp2;5:1;分子;相同;Cl-、H2O;[TiO]n2n+;TiO2+BaCO3 BaTiO3+CO2↑
 ;sp3和sp2;5:1;分子;相同;Cl-、H2O;[TiO]n2n+;TiO2+BaCO3
;sp3和sp2;5:1;分子;相同;Cl-、H2O;[TiO]n2n+;TiO2+BaCO3高溫
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:156引用:2難度:0.1
相似題
-
1.回答下列問題
(1)肼(N2H4)分子可視為NH3分子中的一個氫原子被-NH2取代形成的另一種氮的氫化物。
①NH3分子的空間結構是;N2H4分子中氮原子軌道的雜化類型是。
②肼可用作火箭燃料,燃燒時發生的反應是N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g)ΔH=-1038.7kJ?mol-1,若該反應中有4molN-H斷裂,則形成的π鍵有mol。
③肼能與硫酸反應生成N2H6SO4,N2H6SO4與硫酸銨化合物類型相同,則N2H6SO4晶體不存在(填標號)。
a.離子鍵
b.共價鍵
c.范德華力
(2)第ⅥA族元素氧、硫、硒(Se)的化合物在研究和生產中有許多重要用途。請回答下列問題:
①H2Se的還原性比H2S(填“強”或“弱”)。氣態SeO3分子的空間結構為,SO2的VSEPR模型為,空間結構為。
②H2O內的O-H、水分子間的范德華力和氫鍵,從強到弱依次為,H+可與H2O形成H3O+,H3O+中O采用雜化,H3O+中H-O-H鍵角比H2O中的(填“大”或“小”)發布:2025/1/5 8:0:1組卷:21引用:1難度:0.6 -
2.下列化學用語或圖示正確的是( )
A.NH3和 的VSEPR模型和空間結構均一致NH+4B. 的VSEPR模型:SO2-3
C.丙酮( 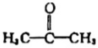 )分子中C原子的雜化類型均是sp2
)分子中C原子的雜化類型均是sp2D.HCl分子中σ鍵的形成: 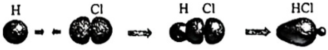 發布:2025/1/5 8:0:1組卷:24引用:2難度:0.5
發布:2025/1/5 8:0:1組卷:24引用:2難度:0.5 -
3.當地時間2020年1月30日晚,世界衛生組織(WHO)宣布,將新型冠狀病毒疫情列為國際關注的突發公共衛生事件,防疫專家表示,75%的醫用酒精、含氯消毒劑(如84消毒液等)可以有效殺滅病毒,佩戴口罩能有效減少感染新冠的危險。下列有關說法正確的是( )
A.制作口罩的原料之一丙烯分子中存在sp2-sp2和sp2-sp3σ鍵 B.乙醇可以和水以任意比互溶的原因只是因為兩者均為極性分子,相似相溶 C.次氯酸的電子式: 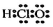
D.乙醇分子中官能團為羥基,在水中形成分子內氫鍵 發布:2025/1/6 6:0:5組卷:6引用:1難度:0.7


