21世紀是海洋的世紀。向海則興、背海則衰。要提高海洋資源開發能力,著力推動海洋經濟向質量效益型轉變。如圖涉及多個以海水為原料的生產流程。
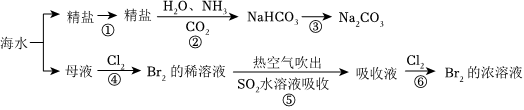
完成下列填空:
(1)寫出步驟③的化學方程式:2NaHCO3 加熱 Na2CO3+CO2↑+H2O2NaHCO3 加熱 Na2CO3+CO2↑+H2O。
(2)工業上用Cl2與KOH(熱溶液)制備KClO3,反應如下:Cl2+KOH→KCl+KClO3+H2O(未配平),上述反應中氧化劑與還原劑的物質的量之比為:5:15:1。
(3)下列說法錯誤的是:BB。
A.步驟④中說明氧化性Cl2大于Br2
B.步驟②既是離子反應又是氧化還原反應
C.步驟⑤中每有1molSO2參加反應生成1molSO2-4轉移2NA個電子
D.第⑤⑥步驟的目的是進行溴的富集,提高Br2的濃度
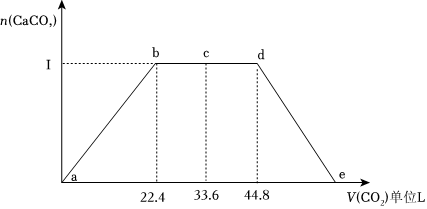
(4)某同學將CO2通入500mlNaOH與Ca(OH)2的混合溶液中,通入CO2的體積(已換算成標準狀況下)與沉淀的量如圖所示,寫出c~d段發生的離子反應方程式:CO2+H2O+CO2-3=2HCO-3CO2+H2O+CO2-3=2HCO-3。由圖可知混合溶液中NaOH的物質的量濃度為 22mol/L。
加熱
加熱
mol
SO
2
-
4
CO
2
-
3
HCO
-
3
CO
2
-
3
HCO
-
3
【考點】海水資源及其綜合利用;從海水中提取溴.
【答案】2NaHCO3 Na2CO3+CO2↑+H2O;5:1;B;CO2+H2O+=2;2
加熱
CO
2
-
3
HCO
-
3
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:24引用:1難度:0.6
相似題
-
1.一位海上遇難的水手,隨著木排在海上漂流.他用完了淡水,感到異常口渴,但他不喝海水,因為他知道海水會致命,主要原因是( )
A.海水有苦澀味,根本喝不下去 B.海水中含有多種鹽,能使腸胃腐爛致人死亡 C.海水中有許多微生物,有些微生物能致人死亡 D.海水會造成人體水分從血液和組織內脫離出來,進入腸胃中,使人脫水死亡 發布:2024/12/27 8:0:2組卷:15引用:2難度:0.9 -
2.海水是一個巨大的資源寶庫,如圖是從海水中提取鎂的流程圖。以下說法錯誤的是( )
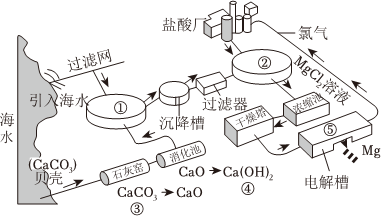
A.反應①~⑤中,氧化還原反應有1個 B.電解槽中的反應在常溫下即可發生,節約能源 C.使用貝殼為原料制備Ca(OH)2,可降低生產成本 D.實驗室模擬濃縮池中的過程,需要在HCl氣氛中蒸發濃縮 發布:2024/11/24 20:30:1組卷:70引用:2難度:0.7 -
3.鎂及其合金是用途很廣的金屬材料。大量的鎂是從海水中提取的,其中的主要步驟如圖:
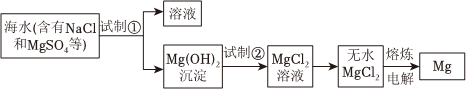
下列說法不正確的是( )A.為了節省原料,海水可選用提取粗食鹽后的母液 B.為了使MgSO4轉化為Mg(OH)2,工業上試劑①主要選用NaOH C.加入試劑①后,可用過濾得到Mg(OH)2沉淀 D.鎂與鋁等金屬按一定比例制成的合金,由于其密度小、強度大,可用于制造飛機 發布:2024/10/27 1:30:1組卷:111引用:2難度:0.8


