實驗小組探究酸對Fe3++3SCN-?Fe(SCN)3 平衡的影響。將0.005mol/L FeCl3溶液(接近無色)和0.01 mol/L KSCN溶液等體積混合,得到紅色溶液。取兩等份紅色溶液,進行如下操作并記錄現象。
(1)FeCl3水解顯酸性的原因是 Fe3++3H2O?Fe(OH)3+3H+Fe3++3H2O?Fe(OH)3+3H+。(用離子方程式表示)
(2)甲同學認為加入酸后,會使Fe3++3SCN-?Fe(SCN)3體系中 Fe3+Fe3+濃度改變,導致該平衡正向移動,溶液顏色加深。
【設計并實施實驗】
【查閱資料】
Fe3+和Cl-、SO2-4均能發生絡合反應:
Fe3++4Cl-?[FeCl4]-(黃色);Fe3++2SO2-4?[Fe(SO4)2]-(無色)。
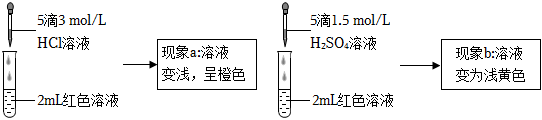
實驗Ⅰ.探究現象a中溶液顏色變化的原因如表1:
表1:
SO
2
-
4
SO
2
-
4
| 編號 | 操作 | 現象 |
| ① | 向2mL紅色溶液中滴加5滴水 | 溶液顏色無明顯變化 |
| ② | 向2mL紅色溶液中滴加5滴3mol/L KCl溶液 | 溶液顏色變淺,呈橙色 |
排除稀釋使溶液顏色變化的干擾
排除稀釋使溶液顏色變化的干擾
。(4)根據實驗①和實驗②的結果,從平衡移動角度解釋現象a:
在Fe3++3SCN-?Fe(SCN)3平衡體系中加入鹽酸,鐵離子、氯離子發生絡合反應,使得鐵離子濃度減小,平衡逆向進行,Fe(SCN)3離子濃度減小,溶液顏色變淺,呈橙色
在Fe3++3SCN-?Fe(SCN)3平衡體系中加入鹽酸,鐵離子、氯離子發生絡合反應,使得鐵離子濃度減小,平衡逆向進行,Fe(SCN)3離子濃度減小,溶液顏色變淺,呈橙色
。實驗Ⅱ.探究現象b中溶液呈淺黃色的原因如表2
表2:
| 編號 | 操作 | 現象 |
| ③ | 取1 mL 0.0025 mol/L Fe2(SO4)3溶液(無色),加入1mL 0.01 mol/L KSCN溶液,再加入5滴1.5 mol/L H2SO4溶液 | 溶液先變紅,加硫酸后變為淺黃色 |
| ④ | 取1 mL 0.005 mol/L FeCl3溶液, 加入蒸餾水,再加入5滴1.5mol/LH2SO4溶液 加入蒸餾水,再加入5滴1.5mol/LH2SO4溶液 |
得到無色溶液 得到無色溶液
|
[FeCl4]-或Fe(SCN)3
[FeCl4]-或Fe(SCN)3
。(6)乙同學進一步補充了實驗④,確證了現象b中使溶液呈淺黃色的微粒只是(5)中的一種,請將實驗④的操作及現象補充完整:
加入蒸餾水,再加入5滴1.5mol/LH2SO4溶液;得到無色溶液
加入蒸餾水,再加入5滴1.5mol/LH2SO4溶液;得到無色溶液
。【答案】Fe3++3H2O?Fe(OH)3+3H+;Fe3+;排除稀釋使溶液顏色變化的干擾;在Fe3++3SCN-?Fe(SCN)3平衡體系中加入鹽酸,鐵離子、氯離子發生絡合反應,使得鐵離子濃度減小,平衡逆向進行,Fe(SCN)3離子濃度減小,溶液顏色變淺,呈橙色;加入蒸餾水,再加入5滴1.5mol/LH2SO4溶液;得到無色溶液;[FeCl4]-或Fe(SCN)3;加入蒸餾水,再加入5滴1.5mol/LH2SO4溶液;得到無色溶液
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/7/8 8:0:10組卷:118引用:6難度:0.7
相似題
-
1.為探究濃度對化學平衡的影響,某同學進行如下實驗,下列說法不正確的是( )
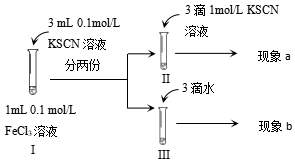
A.該實驗通過觀察顏色變化以判斷生成物濃度的變化 B.觀察到現象a比現象b中紅色更深,即可證明增加反應物濃度,平衡正向移動 C.進行Ⅱ、Ⅲ對比實驗的主要目的是防止由于溶液體積變化引起各離子濃度變化而干擾實驗結論得出 D.若Ⅰ中加入KSCN溶液的體積改為2mL也可以達到實驗目的 發布:2024/5/27 14:0:0組卷:161引用:5難度:0.5 -
2.將5mL 0.005mol/LFeCl3溶液和5mL 0.015mol/LKSCN溶液混合,達到平衡后呈紅色。再將混合液分為5份,分別進行如下實驗:下列說法不正確的是( )
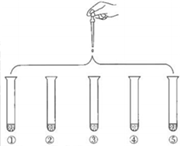
實驗①:滴加4滴蒸餾水,振蕩 實驗②:滴4滴1mol?L-1KCl溶液,振蕩 實驗③:滴4滴飽和FeCl3溶液,振蕩 實驗④:滴4滴1mol?L-1KSCN溶液,振蕩 實驗⑤:滴4滴6mol?L-1NaOH溶液,振蕩 A.實驗③中溶液顏色比實驗①中深 B.對比實驗①和②,可證明增加反應物中某些離子的濃度,平衡發生逆向移動 C.對比實驗①和④,可證明增加反應物濃度,平衡發生正向移動 D.對比實驗①和⑤,可證明減少反應物濃度,平衡發生逆向移動 發布:2024/12/14 8:0:2組卷:46引用:1難度:0.5 -
3.某研究小組利用H2C2O4溶液和酸性KMnO4溶液的反應探究“外界條件的改變對化學反應速率的影響”,進行了如下實驗:
(1)酸性高錳酸鉀溶液與草酸反應的現象為實驗
序號實驗
溫度/K有關物質 溶液顏色褪至無色所需時間/min 酸性KMnO4溶液 H2C2O4溶液 H2O V/mL c/mol?L-1 V mL c/mol?L-1 V/mL A 298 5 0.02 5 0.2 0 t1 B T1 5 0.02 3 0.2 V1 1 C 318 5 0.02 V2 0.2 2 t2 ,反應的離子方程式為。
(2)通過實驗A、B的對比,可探究出反應物濃度的改變對化學反應速率的影響,其中V1=、T1=;通過實驗的對比(填實驗序號),可探究出溫度變化對化學反應速率的影響,其中V2=。
(3)忽略溶液體積的變化,利用實驗B中數據計算,0~1min內,用H2C2O4溶液的濃度變化表示的反應速率v(H2C2O4)=mol?L-1?min-1。
(4)已知,上述實驗過程中Mn2+對反應有催化作用,請畫出n(Mn2+)隨時間變化的圖象。
(5)若實驗室用標準高錳酸鉀溶液滴定待測草酸溶液的物質的量濃度,實驗數據如表所示。
滴定終點的現象為實驗序號 0.1000mol/L高錳酸鉀溶液的體積(mL) 待測草酸溶液的體積(mL) ① 21.08 25.00 ② 21.12 25.00 ③ 21.10 25.00 ④ 24.06 25.00 ,待測草酸溶液的濃度為。發布:2024/4/20 14:35:0組卷:103引用:1難度:0.3


