金屬是一種重要的材料,人類的生活和生產都離不開金屬,全世界每年因生銹損失的鋼鐵,約占世界年產量的十分之一。

(1)小敏同學想探究生銹的條件,他將干凈的鐵釘放入如圖所示的D、E、F三支試管中進行研究。一周后,DD試管中鐵釘生銹明顯。
(2)目前世界上一半以上的銅用于電力工業,主要是因為銅具有 CC(填字母)。
A.導熱性
B.延展性
C.導電性
D.金屬光澤
(3)鋁的活動性比鐵強,但鋁在空氣中卻表現出良好的抗腐蝕性,原因是(用化學方程式表示) 4Al+3O2=2Al2O34Al+3O2=2Al2O3。
(4)某化學興趣小組用一氧化碳與氧化鐵樣品(含少量雜質)的反應來探究煉鐵的原理,請回答有關問題:

①實驗開始時應先 BB(填序號)。
A.先加熱后再通入一氧化碳
B.先通一氧化碳后再加熱
②在反應過程中,硬質玻璃管中發生的反應方程式為 Fe2O3+3CO 高溫 2Fe+3CO2Fe2O3+3CO 高溫 2Fe+3CO2。
(5)若將B裝置改成C虛線框內裝置,還起到的作用是 收集CO收集CO。
(6)取反應后裝置A中固體5.8g放于燒杯中,加入100g稀硫酸恰好完全反應(雜質不溶于水,也不與硫酸發生反應),測得反應后燒杯內剩余物質總質量為105.6g,求硫酸的溶質質量分數?(寫出計算過程)
(7)在工業煉鐵部分原料的作用中:①與鐵礦石發生反應生成鐵②燃燒供熱③除去鐵礦石中少量雜質(如SiO2)④生成CO。屬于從爐頂加入焦炭的作用有 DD(填字母)。
A.①②
B.①③
C.②③
D.②④
高溫
高溫
【答案】D;C;4Al+3O2=2Al2O3;B;Fe2O3+3CO 2Fe+3CO2;收集CO;D
高溫
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:30引用:1難度:0.4
相似題
-
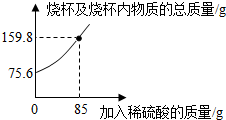 1.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為52.2g的燒杯中,然后緩慢加入一定質量的稀硫酸,當加稀硫酸質量為85g時,反應恰好完全(雜質不反應且產生的氣體全部逸出),反應過程中的質量關系如圖.完成下列問題:
1.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為52.2g的燒杯中,然后緩慢加入一定質量的稀硫酸,當加稀硫酸質量為85g時,反應恰好完全(雜質不反應且產生的氣體全部逸出),反應過程中的質量關系如圖.完成下列問題:
(1)該實驗取用的樣品質量為g.
(2)計算樣品中鐵的質量分數(寫出解題過程).發布:2025/1/9 8:0:2組卷:139引用:39難度:0.1 -
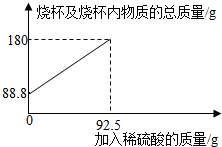 2.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為51.8克的燒杯中,然后逐步加入一定質量分數的稀硫酸,當加入92.5g稀硫酸時恰好完全反應,加入稀硫酸的質量與燒杯及燒杯內物質的總質量的關系如圖。
2.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為51.8克的燒杯中,然后逐步加入一定質量分數的稀硫酸,當加入92.5g稀硫酸時恰好完全反應,加入稀硫酸的質量與燒杯及燒杯內物質的總質量的關系如圖。
(1)該實驗取用的樣品質量為g。
(2)反應后所得溶液中的溶質的質量分數。(寫出計算過程,結果保留一位小數)
(3)反應結束后,小明不慎向燒杯中多加了10g稀硫酸,若在圖中補繪此過程中稀硫酸的質量與燒杯及燒杯內物質的總質量的關系圖,所得線段的終點位于線段AB延長線的(填:上方、下方或線上)。發布:2025/1/9 8:0:2組卷:4引用:1難度:0.3 -
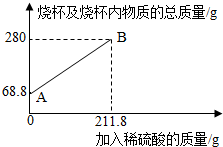 3.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為51.8克的燒杯中,然后逐步加入一定質量分數的稀硫酸,當加入211.8g稀硫酸時恰好完全反應,加入稀硫酸的質量與燒杯及燒杯內物質的總質量的關系如圖。
3.為測定某碳素鋼樣品中鐵的質量分數,現取一定質量的樣品粉末于質量為51.8克的燒杯中,然后逐步加入一定質量分數的稀硫酸,當加入211.8g稀硫酸時恰好完全反應,加入稀硫酸的質量與燒杯及燒杯內物質的總質量的關系如圖。
(1)該實驗取用的樣品質量為g。
(2)求樣品中鐵的質量分數;反應后所得溶液中的溶質的質量分數。(寫出計算過程,結果保留一位小數)
(3)反應結束后,小明不慎向燒杯中多加了20g稀硫酸,若在圖中補繪此過程中稀硫酸的質量與燒杯及燒杯內物質的總質量的關系圖,所得線段的終點位于線段AB延長線的(填:上方、下方或線上)。發布:2025/1/9 8:0:2組卷:8引用:1難度:0.3


