某小組同學利用下圖所示裝置進行鐵的電化學腐蝕原理的探究實驗:
| 裝置 | 分別進行的操作 | 現象 |
 |
Ⅰ.連好裝置一段時間后,向燒杯中滴加酚酞 |
碳棒附近溶液變紅 碳棒附近溶液變紅
|
| Ⅱ.連好裝置一段時間后,向燒杯中滴加 K3[Fe(CN)]6溶液 | 鐵片表面產生藍色沉淀 |
吸氧腐蝕
吸氧腐蝕
。 (哪種電化學腐蝕)①實驗Ⅰ中的現象是
碳棒附近溶液變紅
碳棒附近溶液變紅
。②用電極反應解釋實驗Ⅰ中的現象:
O2+2H2O+4e-═4OH-
O2+2H2O+4e-═4OH-
。③用離子方程式解釋鐵片產生藍色沉淀原因:
3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓
3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓
。(2)查閱資料:K3[Fe(CN)]6具有氧化性。
①據此有同學認為僅通過Ⅱ中現象不能證明鐵發生了電化學腐蝕,理由是
鐵電極能直接和K3[Fe(CN)6]溶液發生氧化還原反應生成Fe2+,會干擾由于電化學腐蝕負極生成Fe2+的檢驗
鐵電極能直接和K3[Fe(CN)6]溶液發生氧化還原反應生成Fe2+,會干擾由于電化學腐蝕負極生成Fe2+的檢驗
。②進行下列實驗,在實驗幾分鐘后的記錄如下:
| 實驗 | 試管中的溶液 | 現象 |
滴入K3[Fe(CN)6] |
Ⅲ.蒸餾水 | 無明顯變化 |
| Ⅳ.1mol/LNaCl | 鐵片表面產生大量藍色沉淀 | |
| Ⅴ.0.5mol/LNa2SO4 | 無明顯變化 |
Cl-存在
Cl-存在
條件下,K3[Fe(CN)]6溶液可以與鐵片發生反應。b.為探究陰離子的存在對此反應的影響,小組同學將鐵片酸洗(用稀硫酸浸泡后洗凈)后再進行實驗iii,發現鐵片表面產生藍色沉淀。此補充實驗表明氯離子的作用是
Cl-破壞了鐵表面的氧化膜
Cl-破壞了鐵表面的氧化膜
。【考點】金屬的腐蝕與防護.
【答案】碳棒附近溶液變紅;吸氧腐蝕;碳棒附近溶液變紅;O2+2H2O+4e-═4OH-;3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓;鐵電極能直接和K3[Fe(CN)6]溶液發生氧化還原反應生成Fe2+,會干擾由于電化學腐蝕負極生成Fe2+的檢驗;Cl-存在;Cl-破壞了鐵表面的氧化膜
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:15引用:1難度:0.4
相似題
-
1.下列敘述與電化學腐蝕有關的是( )
A.炒過菜的鐵鍋不及時清洗易生銹 B.在空氣中金屬鎂具有較好的抗腐蝕性 C.紅熱的鐵絲與水接觸時,表面形成了藍黑色的物質 D.把鐵片投入到氯化銅溶液中,在鐵表面上附著一層紅色的銅 發布:2025/1/6 6:0:5組卷:4引用:3難度:0.7 -
2.用如圖裝置進行鐵的電化學腐蝕實驗。下列說法正確的是( )一段時間后,左側試管發熱,導管口有氣泡產生。
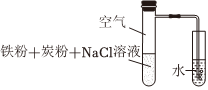
A.鐵發生的電極反應:Fe-3e-═Fe3+ B.鐵腐蝕過程中,化學能轉化為熱能 C.炭粉的存在對鐵腐蝕的速率無影響 D.導管口產生氣泡證明鐵發生了析氫腐蝕 發布:2024/12/12 1:30:1組卷:78引用:2難度:0.7 -
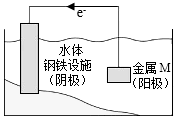 3.將金屬M連接在鋼鐵設施表面,可減緩水體中鋼鐵設施的腐蝕。在如圖所示的情境中,下列有關說法正確的是( )
3.將金屬M連接在鋼鐵設施表面,可減緩水體中鋼鐵設施的腐蝕。在如圖所示的情境中,下列有關說法正確的是( )A.鋼鐵設施表面因積累大量電子而被保護 B.金屬M的活動性比Fe的活動性弱 C.陰極的電極反應式為Fe-2e-=Fe2+ D.鋼鐵設施在河水中的腐蝕速率比在海水中的快 發布:2024/12/10 21:0:1組卷:106引用:4難度:0.7


