某化學課外興趣小組為探究銅與濃硫酸的反應,用如圖所示的裝置進行實驗:
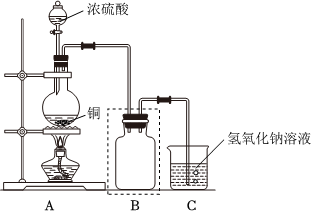
請回答下列問題:
(1)B是用來收集實驗中產(chǎn)生氣體的裝置,但未將導管畫全,請將裝置圖補充完整.
(2)實驗中他們?nèi)?.4g銅片和12mL 18mol?L-1濃硫酸放在圓底燒瓶中共熱,直到反應停止,最后發(fā)現(xiàn)燒瓶中還有銅片剩余,該小組中的同學認為還有一定量的硫酸剩余.
①寫出銅與濃硫酸反應的化學方程式:Cu+2H2SO4(濃) △ CuSO4+SO2↑+2H2OCu+2H2SO4(濃) △ CuSO4+SO2↑+2H2O,實驗中若有m g銅參加了反應,則有 m64m64mol硫酸被氧化,電子轉(zhuǎn)移數(shù)目為 m32m32mol.
②下列試劑中,能證明反應停止后燒瓶中有硫酸剩余的是 DD(填寫字母編號).
A.硫酸鈉溶液 B.氯化鋇溶液 C.銀粉 D.碳酸鈉溶液
③為什么有一定量的硫酸剩余但未能使銅片完全溶解?你認為的原因是 稀硫酸不與銅反應稀硫酸不與銅反應.
(3)為了測定剩余硫酸的物質(zhì)的量濃度,該興趣小組設計了三個實驗方案:
方案一:將裝置A產(chǎn)生的氣體緩緩通過已稱量過的裝有堿石灰的干燥管,反應停止后再次稱量,兩次質(zhì)量差即是吸收的二氧化硫.
方案二:將裝置A產(chǎn)生的氣體緩緩通入足量的用硫酸酸化的高錳酸鉀溶液,再加入足量的氯化鋇溶液,過濾、洗滌、干燥,稱得沉淀的質(zhì)量即是二氧化硫轉(zhuǎn)化為硫酸鋇沉淀的質(zhì)量.
方案三:當銅和濃硫酸的反應結(jié)束后,在裝置A中加入足量的鋅粉,用排水法測得產(chǎn)生氫氣的體積為V L(已換算為標準狀況).
實際上,以上方案一、二均不可取,請你說出原因?方案一 產(chǎn)生的氣體中含有水蒸氣,干燥管中的質(zhì)量差不僅僅是SO2的質(zhì)量(或燒瓶中的二氧化硫不能完全排出)產(chǎn)生的氣體中含有水蒸氣,干燥管中的質(zhì)量差不僅僅是SO2的質(zhì)量(或燒瓶中的二氧化硫不能完全排出);方案二 沉淀的質(zhì)量一部分是高錳酸鉀溶液中起酸化作用的硫酸與氯化鋇反應而產(chǎn)生的沉淀的質(zhì)量一部分是高錳酸鉀溶液中起酸化作用的硫酸與氯化鋇反應而產(chǎn)生的.
方案三:寫出剩余硫酸的物質(zhì)的量濃度的計算式(假設反應后溶液的體積仍為12mL) V22.4×0.012mol/LV22.4×0.012mol/L.
△
△
m
64
m
64
m
32
m
32
V
22
.
4
×
0
.
012
V
22
.
4
×
0
.
012
【考點】濃硫酸的性質(zhì)實驗.
【答案】Cu+2H2SO4(濃) CuSO4+SO2↑+2H2O;;;D;稀硫酸不與銅反應;產(chǎn)生的氣體中含有水蒸氣,干燥管中的質(zhì)量差不僅僅是SO2的質(zhì)量(或燒瓶中的二氧化硫不能完全排出);沉淀的質(zhì)量一部分是高錳酸鉀溶液中起酸化作用的硫酸與氯化鋇反應而產(chǎn)生的;mol/L
△
m
64
m
32
V
22
.
4
×
0
.
012
【解答】
【點評】
聲明:本試題解析著作權屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:51引用:2難度:0.5
相似題
-
1.下列依據(jù)實驗方案和現(xiàn)象對濃硫酸性質(zhì)做出的判斷合理的是( )
實驗方案 實驗I: 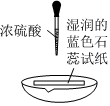
實驗Ⅱ: 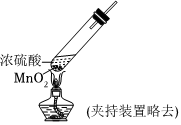
實驗現(xiàn)象 試紙中心區(qū)域變黑,邊緣變紅 黑色固體溶解,溶液接近無色(溶液中錳元素僅以Mn2+存在),產(chǎn)生能使帶火星的木條復燃的無色氣體 A.由Ⅰ可知,濃硫酸具有脫水性 B.由Ⅰ可知,濃硫酸具有弱酸性 C.由Ⅱ可知,濃硫酸具有強氧化性 D.由Ⅱ可知,濃硫酸具有吸水性 發(fā)布:2024/12/30 11:30:1組卷:170引用:8難度:0.5 -
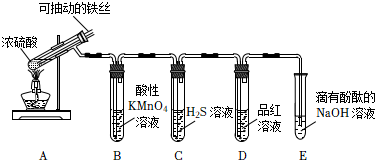 2.實驗室為探究鐵與足量濃硫酸的反應,并驗證SO2的性質(zhì),設計如圖所示裝置進行實驗,下列說法錯誤的是( )
2.實驗室為探究鐵與足量濃硫酸的反應,并驗證SO2的性質(zhì),設計如圖所示裝置進行實驗,下列說法錯誤的是( )A.實驗結(jié)束后,可取A中試管內(nèi)的溶液稀釋后滴加KSCN溶液檢驗是否有Fe3+ B.B中溶液紫色褪去,C中生成淡黃色沉淀,均體現(xiàn)了SO2的還原性 C.D中品紅溶液褪色,體現(xiàn)了SO2的漂白性 D.E中溶液紅色變淺,體現(xiàn)了SO2酸性氧化物的性質(zhì) 發(fā)布:2024/12/30 14:0:1組卷:116引用:3難度:0.7 -
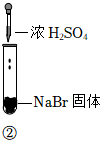
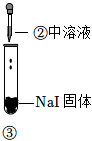
3.某小組同學探究濃硫酸的性質(zhì),向試管①、②中加入等量的98%的濃硫酸,實驗如下。下列對實驗的分析不合理的是( )
實驗1 實驗2 實驗3 裝置 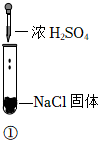
現(xiàn)象 溶液顏色無明顯變化;把蘸濃氨水的玻璃棒靠近試管口,產(chǎn)生白煙 溶液變黃;把濕潤的品紅試紙靠近試管口,試紙褪色 溶液變深紫色(經(jīng)檢驗溶液含單質(zhì)碘) A.實驗1中,白煙是NH4Cl B.根據(jù)實驗1和實驗2判斷還原性:Br->Cl- C.根據(jù)實驗3判斷還原性:I->Br- D.上述實驗體現(xiàn)了濃H2SO4的強氧化性、難揮發(fā)性等性質(zhì) 發(fā)布:2024/12/30 7:30:1組卷:193引用:5難度:0.7


