實驗室中常用二氧化錳與濃鹽酸共熱制取氯氣。某化學興趣小組為制取較為純凈、干燥的氯氣,設計了如圖實驗裝置。

請按要求回答下列問題:
(1)儀器X的名稱為 圓底燒瓶圓底燒瓶,其中發生反應的化學方程式為 MnO2+4HCl(濃) △ MnCl2+Cl2↑+2H2OMnO2+4HCl(濃) △ MnCl2+Cl2↑+2H2O。
(2)欲除去Cl2中的HCl,裝置B中應選用的試劑為 aa(填序號)。
a.飽和食鹽水
b.飽和氫氧化鈉溶液
c.飽和亞硫酸鈉溶液
(3)進入裝置B的Cl2中含有的雜質,除HCl外還有 H2OH2O(填化學式)。欲除去該雜質,裝置C中盛放的試劑名稱為 濃硫酸濃硫酸。
(4)裝置D中的一處明顯錯誤為 D中的導氣管應該左長右短D中的導氣管應該左長右短。
(5)裝置E中的試劑為 NaOHNaOH,其作用為 去除多余的氯氣去除多余的氯氣。
(6)加熱150mL12mol/LHCl溶液和3.48gMnO2粉末的混合物,若反應充分進行,則理論上可產生的Cl2在標準狀況下的體積為 896896mL。
△
△
【考點】氯氣的實驗室制法.
【答案】圓底燒瓶;MnO2+4HCl(濃) MnCl2+Cl2↑+2H2O;a;H2O;濃硫酸;D中的導氣管應該左長右短;NaOH;去除多余的氯氣;896
△
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/8/24 0:0:8組卷:119引用:2難度:0.7
相似題
-
1.為了驗證干燥的氯氣無漂白性,濕潤的氯氣具有漂白性,某同學設計實驗如圖.其中B、C、D、E、F分別盛有飽和食鹽水、濃硫酸.干燥紅色布條、濃硫酸、濕潤紅色布條.
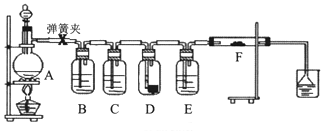
請回答:
(1)E中濃硫酸的作用.
(2)將F中的濕潤布條換成卷曲的細銅絲,并用酒精燈加熱,可看到的現象是.
(3)若用裝置A制取2.24L(標況)氯氣,消耗10mol/L濃鹽酸的體積明顯大于40mL,造成該結果的可能原因有.
A.濃鹽酸的揮發 B.隨反應進行鹽酸濃度下降
C.加熱時火力不夠猛 D.MnO2固體過量.發布:2025/1/15 8:0:2組卷:17引用:1難度:0.3 -
2.如圖是某同學設計的氯氣制備及性質驗證實驗裝置。相關說法正確的是( )

A.脫脂棉中的無水氯化鈣可以用堿石灰代替 B.該實驗裝置可證明干燥的氯氣沒有漂白作用 C.濕潤的紫色石蕊試紙變紅色,說明反應生成了酸性物質 D.濕潤的淀粉碘化鉀試紙變藍色,然后又逐漸褪去,說明氯氣具有漂白性 發布:2025/1/15 8:0:2組卷:21引用:2難度:0.8 -
3.實驗室中模擬用甲烷與氯氣反應得到的副產品來制取鹽酸,原理如圖,下列說法不正確的是( )
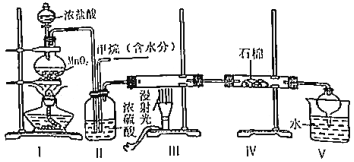
A.依據裝管Ⅰ中的現象控制氣流的速度 B.分離裝置V中鹽酸的最佳操作方法是分液 C.裝置Ⅳ的石棉中可加入一些氫氧化鈉粉末 D.實驗過程中可觀察到裝置Ⅲ中硬質玻璃管內壁有附著的油珠 發布:2024/12/30 17:0:5組卷:61引用:1難度:0.7


