當前位置:
試題詳情
Ⅰ.MgH2擁有很高的儲氫密度,相對便宜的價格以及良好的可逆儲氫性能,在儲氫材料中具有重要作用和地位,一直都是廣大研究者關注的焦點。回答下列問題:
(1)請寫出MgH2的電子式:[H:]-Mg2+[H:]-[H:]-Mg2+[H:]-。
(2)MgH2能與H2O反應生成白色沉淀Mg(OH)2和H2,NH3與H2O類似,MgH2與NH3反應也生成氫氣,反應原理類似,請寫出反應的化學方程式:MgH2+2NH3=Mg(NH2)2+2H2MgH2+2NH3=Mg(NH2)2+2H2。
Ⅱ.(3)尿素(H2NCONH2)水解生成H2NCOONH4(氨基甲酸銨,簡稱甲胺),甲胺不穩定,迅速分解生成兩種氣態化合物,溶于水后,一個呈酸性,一個呈堿性,請寫出甲胺受熱分解的化學方程式:H2NCOONH4 △ CO2↑+2NH3↑H2NCOONH4 △ CO2↑+2NH3↑。
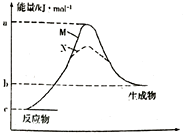
(4)甲胺在不同條件下分解的能量變化如圖所示,N過程與M過程相比,N過程活化能大大降低的原因可能是N過程使用了催化劑,改變了反應的途徑,大大降低了活化能N過程使用了催化劑,改變了反應的途徑,大大降低了活化能;△H=b-cb-ckJ?mol-1。
Ⅲ.氨呈弱堿性,氨燃料與堿性燃料電池是一對較好的組合,直接氨堿性(膜)燃料電池總的化學方程式為:4NH3+3O2═2N2+6H2O,工作原理如圖。
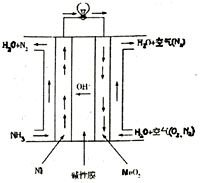
(5)MnO2電極為極正正(填“正”或“負”),寫出Ni電極的電極反應式:2NH3-6e-+6OH-═N2+6H2O2NH3-6e-+6OH-═N2+6H2O。
△
△
【答案】[H:]-Mg2+[H:]-;MgH2+2NH3=Mg(NH2)2+2H2;H2NCOONH4 CO2↑+2NH3↑;N過程使用了催化劑,改變了反應的途徑,大大降低了活化能;b-c;正;2NH3-6e-+6OH-═N2+6H2O
△
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:5引用:1難度:0.7
相似題
-
1.類推時要注意物質的相似性和特殊性,下列類推結論正確的是( )
選項 化學事實 類推結論 A 鈉與水反應生成NaOH和H2 高溫下鐵與水反應也生成堿和H2 B 溶解度:CaCO3<Ca(HCO3)2 溶解度:Na2CO3<NaHCO3 C 氫氧化鋁加熱分解為金屬氧化物和水 氫氧化鎂、氫氧化鐵也能加熱分解生成相應的金屬氧化物和水 D 碳酸鈉、碳酸氫鈉溶液均顯堿性 鈉鹽溶液均能使酚酞變紅 A.A B.B C.C D.D 發布:2024/12/30 5:0:1組卷:57引用:2難度:0.7 -
2.金屬及其化合物的轉化關系是化學學習的重要內容之一、下列各組物質的轉化關系,不能均由一步反應實現的是( )
A.Al→Al2O3→Al(OH)3→AlCl3 B.Fe→FeCl2→Fe(OH)2→Fe(OH)3 C.Mg→MgCl2→Mg(OH)2→MgSO4 D.Na→NaOH→Na2CO3→NaCl 發布:2024/11/25 13:0:1組卷:142引用:7難度:0.5 -
3.若用鎂鋁合金混合物、稀硫酸、稀鹽酸、NaOH溶液制取MgCl2、Al2(SO4)3溶液,
(1)先將廢料加入到氫氧化鈉溶液中,發生反應的離子方程式是.
(2)過濾,將難溶物加入到中,可得到溶液,反應的離子方程式是.
(3)向(2)中濾液加入適量的,反應的離子方程式為:.再過濾,將沉淀物加入到中,可得到溶液,反應的離子方程式是.發布:2024/12/31 8:0:1組卷:16引用:1難度:0.5


