鈉是一種非常活潑、具有廣泛應用的金屬。
(1)鈉的原子結構示意圖為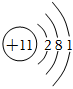 ,鈉在反應中容易 失去失去(填“得到”或“失去”)電子。
,鈉在反應中容易 失去失去(填“得到”或“失去”)電子。
(2)金屬鈉非常活潑,通常保存在 煤油煤油里,以隔絕空氣。
(3)汽車安全氣囊的氣體發生劑NaN3可由金屬鈉生產。某汽車安全氣囊內含NaN3、Fe2O3和NaHCO3等物質。
ⅰ.當汽車發生較嚴重的碰撞時,引發NaN3分解2NaN3═2Na+3N2,從而為氣囊充氣。N2的電子式為 
 。
。
ⅱ.產生的Na立即與Fe2O3發生置換反應生成Na2O,化學方程式是 Fe2O3+6Na=2Fe+3Na2OFe2O3+6Na=2Fe+3Na2O。
ⅲ.NaHCO3是冷卻劑,吸收產氣過程釋放的熱量。NaHCO3起冷卻作用時發生反應的化學方程式為 2NaHCO3 △ Na2CO3+CO2↑+H2O2NaHCO3 △ Na2CO3+CO2↑+H2O。
ⅳ.一個安全氣囊通常裝有50 g NaN3,其完全分解所釋放的N2為 1.151.15mol。
(4)工業通過電解NaCl生產金屬鈉:2NaCl(熔融) 電解 2Na+Cl2↑,過程如圖:
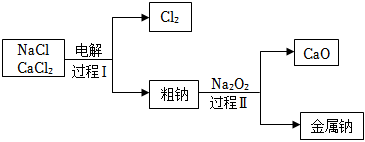
已知:電解時需要將NaCl加熱至熔融狀態。NaCl的熔點為801℃,為降低能耗,通常加入CaCl2從而把熔點降至約580℃。
①把NaCl固體加熱至熔融狀態,目的是 電離出鈉離子和氯離子電離出鈉離子和氯離子。
②電解時,要避免產生的Na與Cl2接觸而重新生成NaCl.用電子式表示NaCl的形成過程 
 。
。
③粗鈉中含有少量雜質Ca,過程Ⅱ除去Ca的化學方程式是 2Ca+Na2O2=2Na+2CaO2Ca+Na2O2=2Na+2CaO。
④過程Ⅰ中,CaCl2能發生像NaCl那樣的電解反應而被消耗。但在過程Ⅰ中CaCl2卻不斷地被重新生成,原因是 鈣的金屬性強于鈉,和氯氣反應生成氯化鈣鈣的金屬性強于鈉,和氯氣反應生成氯化鈣。


△
△
電解


【答案】失去;煤油; ;Fe2O3+6Na=2Fe+3Na2O;2NaHCO3 Na2CO3+CO2↑+H2O;1.15;電離出鈉離子和氯離子;
;Fe2O3+6Na=2Fe+3Na2O;2NaHCO3 Na2CO3+CO2↑+H2O;1.15;電離出鈉離子和氯離子; ;2Ca+Na2O2=2Na+2CaO;鈣的金屬性強于鈉,和氯氣反應生成氯化鈣
;2Ca+Na2O2=2Na+2CaO;鈣的金屬性強于鈉,和氯氣反應生成氯化鈣
 ;Fe2O3+6Na=2Fe+3Na2O;2NaHCO3
;Fe2O3+6Na=2Fe+3Na2O;2NaHCO3 △
 ;2Ca+Na2O2=2Na+2CaO;鈣的金屬性強于鈉,和氯氣反應生成氯化鈣
;2Ca+Na2O2=2Na+2CaO;鈣的金屬性強于鈉,和氯氣反應生成氯化鈣【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:123引用:2難度:0.7
相似題
-
1.正丙醇(CH3CH2CH2OH)和鈉反應要比水和鈉反應劇烈。
(判斷對錯)發布:2024/12/30 15:0:1組卷:7引用:2難度:0.6 -
2.在下列物質中,分別加入金屬鈉,不能產生氫氣的是( )
A.蒸餾水 B.乙酸 C.無水乙醇 D.苯 發布:2024/12/30 9:30:2組卷:15引用:2難度:0.9 -
3.表述I與表述II中,兩者之間因果關系錯誤的是( )
選項 表述Ⅰ 表述Ⅱ A 金屬鈉保存在煤油中,以隔絕空氣 常溫下,金屬鈉在空氣中會發生反應 B 用FeCl3溶液腐蝕印刷電路板 FeCl3溶液能與Cu反應 C 將干燥的氯氣通入盛有紅色鮮花的集氣瓶中,鮮花褪色 干燥的氯氣具有漂白性 D 氫氧化鋁可用于治療胃酸過多 氫氧化鋁可與鹽酸反應 A.A B.B C.C D.D 發布:2025/1/15 8:0:2組卷:23引用:2難度:0.7


