某實驗小組探究Mn2+的檢測方法。
查閱資料:Mn2+的稀溶液幾乎無色,在酸性介質中,S2O82-能將Mn2+氧化成MnO4-。
(1)資料中檢測Mn2+方法的反應為 2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+(用離子方程式表示)。甲同學設計實驗如表。
| 序號 | 實驗操作 | 實驗現象 |
| Ⅰ | 向1mL0.002mol?L-1MnSO4溶液中滴入3滴3mol?L-1H2SO4溶液并加入一粒米大的K2S2O8固體 | 5min無明顯現象 |
| 序號 | 實驗操作 | 實驗現象 |
|
Ⅱ |
向1mL0.002mol?L-1MnSO4溶液中滴入3滴3mol?L-1H2SO4溶液并加入一粒米大的K2S2O8固體,加熱至沸騰 | 溶液變棕黃色,1min后出現紫紅色 |
|
Ⅲ |
向1mL0.002mol?L-1MnSO4溶液中滴入3滴3mol?L-1H2SO4溶液并加入一粒米大的K2S2O8固體,再滴入2滴0.1mol?L-1AgNO3溶液 | 溶液變棕黃色,5min出現紫紅色 |
|
Ⅳ |
向1mL0.05mol?L-1MnSO4溶液中滴入3滴3mol?L-1H2SO4溶液并加入一粒米大的K2S2O8固體,加熱至沸騰 | 迅速生成棕黑色沉淀 |
反應速率較慢
反應速率較慢
。②解釋實驗Ⅱ、Ⅲ中溶液變棕黃色的原因
S2O82-能將Mn2+氧化成MnO4-,但反應速率慢,生成的MnO4-濃度相對很小,相對過量的Mn2+就會還原體系中生成的MnO4-而形成少量MnO2
S2O82-能將Mn2+氧化成MnO4-,但反應速率慢,生成的MnO4-濃度相對很小,相對過量的Mn2+就會還原體系中生成的MnO4-而形成少量MnO2
。③結合離子方程式解釋實驗Ⅳ中產生棕黑色沉淀的原因
3Mn2++2MnO4-+2H2O=5MnO2+4H+,溶液中Mn2+濃度過大,體系中過量Mn2+會還原生成的MnO4-生成大量黑色MnO2沉淀
3Mn2++2MnO4-+2H2O=5MnO2+4H+,溶液中Mn2+濃度過大,體系中過量Mn2+會還原生成的MnO4-生成大量黑色MnO2沉淀
。(3)乙同學繼續設計實驗
| 序號 | 實驗操作 | 實驗現象 |
|
Ⅴ |
向1mL0.002mol?L-1MnSO4溶液中滴入3滴3mol?L-1H2SO4溶液并加入一粒米大的K2S2O8固體+ 2滴0.1mol?L-1AgNO3溶液 2滴0.1mol?L-1AgNO3溶液 ,微熱 |
1min后出現紫紅色 |
(4)總結:探究Mn2+的檢測方法需要考慮的因素有
溫度、催化劑、Mn2+濃度
溫度、催化劑、Mn2+濃度
。【考點】物質檢驗實驗方案的設計.
【答案】2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+;反應速率較慢;S2O82-能將Mn2+氧化成MnO4-,但反應速率慢,生成的MnO4-濃度相對很小,相對過量的Mn2+就會還原體系中生成的MnO4-而形成少量MnO2;3Mn2++2MnO4-+2H2O=5MnO2+4H+,溶液中Mn2+濃度過大,體系中過量Mn2+會還原生成的MnO4-生成大量黑色MnO2沉淀;2滴0.1mol?L-1AgNO3溶液;溫度、催化劑、Mn2+濃度
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:42引用:1難度:0.4
相似題
-
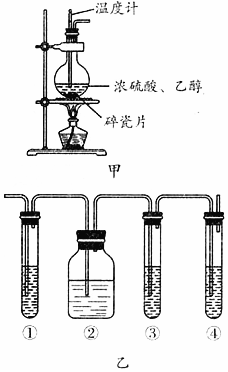 1.實驗室常用如圖甲所示裝置制取乙烯,反應原理為CH3CH2OHCH2═CH2↑+H2O。實驗中常觀察到反應混合液變黑,產生的氣體能使品紅溶液褪色。某同學設計如圖乙所示裝置進行實驗,以確認上述混合氣體中是否含有乙烯和二氧化硫。試回答下列問題:濃硫酸170℃
1.實驗室常用如圖甲所示裝置制取乙烯,反應原理為CH3CH2OHCH2═CH2↑+H2O。實驗中常觀察到反應混合液變黑,產生的氣體能使品紅溶液褪色。某同學設計如圖乙所示裝置進行實驗,以確認上述混合氣體中是否含有乙烯和二氧化硫。試回答下列問題:濃硫酸170℃
(1)SO2產生的原因是(用化學方程式加以說明)。
(2)圖乙中①②③④裝置應盛放的試劑是(填字母):
①;②;③;④。
A.品紅溶液
B.氫氧化鈉溶液
C.濃硫酸
D.酸性高錳酸鉀溶液
(3)能說明二氧化硫氣體存在的現象是。
(4)使用裝置②的目的是。
(5)使用裝置③的目的是。
(6)確認含有乙烯的現象是。發布:2024/12/30 15:0:1組卷:3引用:2難度:0.6 -
2.化合物SOI2、SOBr2、SOCl2、SOClF、SF4、SBrF3、SOBrCl在水中容易水解,但不發生氧化還原反應,所有產物都是可溶的。現將其中的一種化合物A配成溶液,稀釋后分成幾份,分別加入一系列0.1mol?L-1的試劑(已知氟化鈣難溶于水)。列表如下:根據實驗結果,下列實驗結論不正確的是( )
加入試劑 測出結果 實驗結論 硝酸和硝酸銀 產生淡黃色沉淀 (a) 氯化鎂 無沉淀 溶液微熱后,再用NH3將pH調到7,然后加入硝酸鈣 無明顯反應 (b) 向該物質的酸性溶液中加入高錳酸鉀,然后加入硝酸鋇 高錳酸鉀的特征顏色消失,加入硝酸鋇后產生白色沉淀 氯化鐵、四氯化碳 四氯化碳層不顯紫色 (c) A.實驗結論(a)一定含有Br-,可能含有Cl- B.實驗結論(b)排除F- C.實驗結論(c)排除I- D.該化合物的化學式是SOBr2 發布:2024/12/21 23:30:7組卷:33引用:1難度:0.5 -
3.鹵代烴A(C2H5X)是一種無色液體,為探究A的性質,設計如下實驗方案。
方案一:往A中加入硝酸銀溶液,充分振蕩,靜置。
方案二:往A中加過量NaOH水溶液,充分振蕩,靜置,待液體分層后,取“水層”溶液少許,滴加硝酸銀溶液。
方案三:往A中加入過量NaOH乙醇溶液,共熱,充分反應后,取溶液少許,依次加入試劑B、硝酸銀溶液,得淺黃色沉淀。
根據以上信息回答問題。
(1)C2H5X中的X是(寫元素符號)。
(2)方案一中可觀察到溶液分層,設計簡便方法,判斷何為“水層”。
(3)有人認為方案二達不到檢驗X-的實驗目的,理由是。
(4)方案三中,試劑B是。寫出方案三中發生反應的化學方程式;;。
(5)將A與過量NaOH乙醇溶液共熱生成的氣體通入溴的四氯化碳溶液中,溶液褪色,原因是。發布:2024/12/30 10:0:2組卷:15引用:5難度:0.6
相關試卷


