氧化還原反應的學習,為我們研究化學物質(zhì)和化學反應提供了新的視角:
(1)下列粒子中,只有還原性的是 ①⑦①⑦(填序號).
①S2-
②Fe2+
③Mg
④Cl2
(2)吸入人體內(nèi)的氧有2%轉(zhuǎn)化為氧化性極強的“活性氧”,它能加速人體衰老,被稱為“生命殺手”,服用維生素C能消除人體內(nèi)的活性氧,由此推斷維生素C的作用是 還原劑還原劑.
(3)高鐵酸鈉(Na2FeO4)是一種新型綠色消毒劑,濕法制備高鐵酸鈉的原理為:3NaClO+2Fe(OH)3+4NaOH═2Na2FeO4+3NaCl+5H2O.該反應中氧化劑是 NaClONaClO;被氧化的元素是 鐵元素鐵元素(填名稱).
(4)配平下列方程式:1010Al+66NaNO3+44NaOH═1010NaAlO2+33N2↑+22H2O
(5)已知反應:①6HCl+KClO3═KCl+3H2O+3Cl2↑②Cl2+2KI═2KCl+I2
③I2+Cl2+H2O→HIO3+HCl(未配平)
a)使用單線橋法標出反應①6HCl+KClO3═KCl+3H2O+3Cl2↑的電子轉(zhuǎn)移方向和數(shù)目 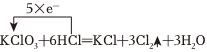
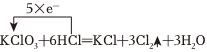 .
.
b)根據(jù)以上三個方程式判斷,下列說法正確的是 BDBD.
A.還原性由強到弱順序:Cl->I-
B.氧化性由強到弱順序:KClO3>Cl2>I2
C.反應③中氧化劑和還原劑的系數(shù)之比為1:5
D.結(jié)合反應②③,將足量Cl2通入含有淀粉的KI溶液中,可能會觀察到先變藍后褪色
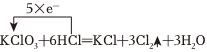
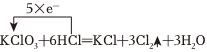
【答案】①⑦;還原劑;NaClO;鐵元素;10;6;4;10;3;2;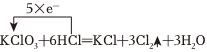 ;BD
;BD
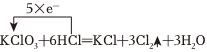 ;BD
;BD【解答】
【點評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復制發(fā)布。
發(fā)布:2024/4/20 14:35:0組卷:35引用:3難度:0.5
相似題
-
1.根據(jù)下列兩個反應判斷:2Cu+O2=2CuO,2Cu+S=Cu2S,下列敘述中錯誤的是( )
A.硫和氧氣反應中作氧化劑 B.氧氣的氧化性比硫強 C.硫的氧化性比氧氣強 D.銅是一種具有可變化合價的元素 發(fā)布:2024/12/30 14:30:1組卷:16引用:2難度:0.9 -
2.實驗證明,在一定溫度和壓強下,用銅的化合物做催化劑,甲烷(CH4)與氧氣反應只生成甲醇(CH3OH)。下列敘述正確的是( )
A.甲烷是有機物,甲醇是氧化物 B.該反應及時氧化還原反應又是化合反應 C.該反應中甲醇是還原產(chǎn)物,甲烷是氧化劑 D.該反應的化學方程式為CH4+O2═CH3OH 發(fā)布:2025/1/7 8:0:2組卷:2引用:1難度:0.7 -
3.將適量的SO2通入Fe(NO3)3溶液中,溶液逐漸由棕黃色變?yōu)闇\綠色,但又立即變?yōu)樽攸S色,繼續(xù)滴入BaCl2溶液,產(chǎn)生白色沉淀。在上述一系列變化過程中,最終被還原的元素是( )
A.氮 B.硫 C.鐵 D.氧 發(fā)布:2024/12/30 14:30:1組卷:27引用:2難度:0.6
相關(guān)試卷


