硫元素是動植物生長不可缺少的元素,圖1是自然界中硫元素的存在示意圖。圖2是硫元素的常見化合價與部分物質類別的對應關系,回答下列問題。
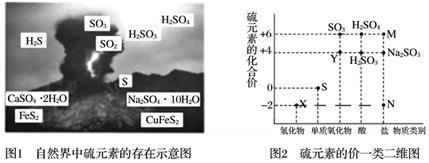
(1)圖1中與圖2中M對應的物質是 Na2SO4?10H2O(或CaSO4?2H2O)Na2SO4?10H2O(或CaSO4?2H2O);N對應的物質中鐵元素的化合價為 +2+2。
(2)X與Y能發生反應,還原劑與氧化劑的物質的量之比為 2:12:1。
(3)Na2SO3溶液易變質,實驗室檢驗Na2SO3溶液是否變質的基本操作是 取少量溶液于試管中,先滴加鹽酸酸化至無氣泡產生,再滴加氯化鋇溶液,看是否產生白色沉淀,若產生白色沉淀,則Na2SO3溶液已變質取少量溶液于試管中,先滴加鹽酸酸化至無氣泡產生,再滴加氯化鋇溶液,看是否產生白色沉淀,若產生白色沉淀,則Na2SO3溶液已變質。
(4)硫酸是用途廣泛的化工原料,可作脫水劑、吸水劑、氧化劑和催化劑等。甲、乙兩位同學用銅和硫酸做原料,設計了兩種制取硫酸銅的方案。
方案甲:銅與濃硫酸加熱直接反應,即Cu→CuSO4
方案乙:由Cu→CuO→CuSO4
①方案甲中銅和濃硫酸反應的化學方程式是 Cu+2H2SO4(濃) △ CuSO4+SO2↑+2H2OCu+2H2SO4(濃) △ CuSO4+SO2↑+2H2O。該反應體現了濃硫酸的 強氧化性和酸強氧化性和酸性。
②這兩種方案,你認為哪一種方案更合理?方案乙方案乙。理由是 無污染,且節約原料無污染,且節約原料。
△
△
【答案】Na2SO4?10H2O(或CaSO4?2H2O);+2;2:1;取少量溶液于試管中,先滴加鹽酸酸化至無氣泡產生,再滴加氯化鋇溶液,看是否產生白色沉淀,若產生白色沉淀,則Na2SO3溶液已變質;Cu+2H2SO4(濃) CuSO4+SO2↑+2H2O;強氧化性和酸;方案乙;無污染,且節約原料
△
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:53引用:3難度:0.8
相似題
-
1.某研究小組成員在討論鑒別濃硫酸和稀硫酸的方案時,收集了如下方案:
(1)其中可行的是方案 操作 結論 甲 將火柴梗分別放入其中 變黑者為濃硫酸 乙 分別加入金屬鋁片 產生刺激性氣味者為濃硫酸 丙 分別加入盛水的試管中 放熱者為濃硫酸 丁 分別在CuSO4?5H2O晶體上滴加二者 變白者為濃硫酸 (填“甲”“乙”“丙”“丁”)。
(2)對其中一個操作稍做改進就能成為可行方案的是,改進方法是。
(3)請給出另外兩種鑒別方案,完成表格。方案 操作 結論 A B 發布:2024/12/30 7:0:1組卷:3引用:3難度:0.6 -
2.兩支試管中分別盛有濃硫酸和稀硫酸,某同學使用的下列4種方法中,能鑒別出哪支試管盛濃硫酸的方法有( )
①加入銅片(加熱);②加入鐵片;③加入膽礬; ④加入氯化鋇.A.1 種 B.2種 C.3種 D.4種 發布:2024/12/30 15:0:1組卷:9引用:2難度:0.9 -
3.下列說法正確的是( )
A.工業制備硫酸流程中用水吸收三氧化硫生成煙硫酸 B.氨水可以導電,因此氨水是電解質 C.市售硝酸的質量分數為68%~70%,常因溶有少量NO2而略顯黃色 D.常溫下可以用鐵制容器盛裝濃硫酸,原因是濃硫酸與鐵不反應 發布:2024/12/31 8:0:1組卷:4引用:0難度:0.7


