碳是形成化合物種類最多的元素,其單質及化合物是人類生產生活的主要能源物質。請回答下列問題:
(1)有機物M經過太陽光光照可轉化成N,轉化過程如圖: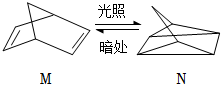 ΔH=+88.6kJ?mol-1則M、N相比,較穩定的是 MM。(用字母“M”或“N”表示)
ΔH=+88.6kJ?mol-1則M、N相比,較穩定的是 MM。(用字母“M”或“N”表示)
(2)已知CH3OH(l)的燃燒熱ΔH=-238.6kJ/mol,CH3OH(l)+12O2(g)═CO2(g)+2H2(g)ΔH=-a kJ/mol,則a <<-238.6(填“>”、“<”或“=”)。
(3)使Cl2和H2O(g)通過灼熱的炭層,生成HCl和CO2,當有1molCl2參與反應時釋放出145kJ熱量,寫出該反應的熱化學方程式:2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g)ΔH=-290.0 kJ?mol-12Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g)ΔH=-290.0 kJ?mol-1。
(4)火箭和導彈表面的薄層是耐高溫物質.將石墨、鋁粉和二氧化鈦按一定比例混合在高溫下煅燒,所得物質可作耐高溫材料,4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s)ΔH=-1176kJ/mol,則反應過程中,還原產物是 TiCTiC,每轉移1mol電子放出的熱量為 9898kJ。
(5)蓋斯定律在生產和科學領域有很重要的意義。有些反應的反應熱雖然無法直接測得,但可通過間接的方法測定。現根據下列3個熱化學反應方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)ΔH=-24.8kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)ΔH=-47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)ΔH=+640.4kJ/mol
寫出CO氣體還原FeO固體得到Fe固體和CO2氣體的熱化學反應方程式:CO(g)+FeO(s)=Fe(s)+CO2(g)ΔH=-218kJ/molCO(g)+FeO(s)=Fe(s)+CO2(g)ΔH=-218kJ/mol。
1
2
【考點】反應熱和焓變.
【答案】M;<;2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g)ΔH=-290.0 kJ?mol-1;TiC;98;CO(g)+FeO(s)=Fe(s)+CO2(g)ΔH=-218kJ/mol
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:20引用:3難度:0.5
相似題
-
1.下列與化學反應的能量變化有關的敘述正確的是( )
A.由石墨比金剛石穩定可知,C(金剛石)═C(石墨)△H<0 B.一個反應的反應物的總能量可能等于其生成物的總能量 C.有熱量變化的反應一定是化學反應 D.強酸與強堿的中和反應的熱化學方程式均可表示為H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ?mol-1 發布:2025/1/6 6:0:5組卷:1引用:3難度:0.6 -
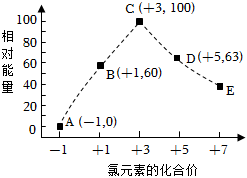 2.一定條件下,在水溶液中物質的量均為1mol的Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相對大小如圖所示。圖中最穩定的點為( )
2.一定條件下,在水溶液中物質的量均為1mol的Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相對大小如圖所示。圖中最穩定的點為( )A.A B.B C.C D.D 發布:2025/1/6 6:0:5組卷:0引用:1難度:0.9 -
3.下列說法不正確的是( )
A.CH3COOH 溶液加水稀釋后,溶液中 的值減小c(CH3COOH)c(CH3COO-)B.已知一定溫度下,醋酸溶液的物質的量濃度為c,電離度為α,Ka= .若加入少量醋酸鈉固體,則CH3COOH?CH3COO-+H+向左移動,α減小,Ka變小(cα)2c(1-α)C.實驗測得環己烷(l)、環己烯(l)和苯(l)的標準燃燒熱分別為-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以證明在苯分子中不存在獨立的碳碳雙鍵 D.已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g),△H=+489.0 kJ/mol.
CO(g)+O2(g)═CO2(g),△H=-283.0 kJ/mol.12
C(石墨)+O2(g)═CO2(g),△H=-393.5 kJ/mol.
則4Fe(s)+3O2(g)═2Fe2O3(s),△H=-1641.0 kJ/mol發布:2025/1/1 8:0:2組卷:11引用:1難度:0.7


