硫酸銅及硫酸銅晶體(CuSO4?5H2O俗稱膽礬,相對分子質量為250)廣泛應用于生產、生活及實驗中。
Ⅰ、結構與類別
(1)構成硫酸銅的微觀粒子是 Cu2+、SO2-4Cu2+、SO2-4(填符號)。
(2)硫酸銅屬于 AEAE(填字母)。
A.化合物
B.氧化物
C.酸
D.堿
E.鹽
Ⅱ、性質
(3)農藥波爾多液由硫酸銅和石灰乳等配制而成,其中兩種主要成分 能能(填“能”或“不能”)發生復分解反應,判斷依據是 反應產生沉淀反應產生沉淀。
(4)CuSO4溶液對過氧化氫的分解具有催化作用,寫出該反應的化學方程式 2H2O2 CuSO4 2H2O+O2↑2H2O2 CuSO4 2H2O+O2↑。
(5)將25.0g膽礬加熱,固體質量與成分的溫度變化的曲線如圖。
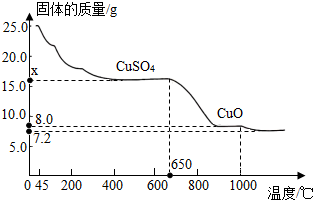
①根據膽礬分解的化學方程式CuSO4?5H2O △ CuSO4+5H2O,計算出圖中x的值是 16.016.0。
②650℃時,CuSO4開始發生分解反應,生成CuO和另一種氧化物,則該反應的化學方程式為 CuSO4 650℃ CuO+SO3↑CuSO4 650℃ CuO+SO3↑。
③剩余7.2g固體中銅元素和氧元素的質量比為 8:18:1(填最簡整數比)。
Ⅲ、應用
某興趣小組同學利用下列裝置檢驗某氣體的成分,該氣體中含水蒸氣、甲烷、氫氣中的一種或幾種(夾持儀器未畫出,假設每步反應均完全)。
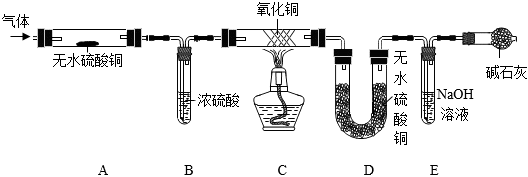
已知:CH4+4CuO △ 4Cu+CO2+2H2O(假設該實驗過程中甲烷只發生此反應)。
(6)檢驗該氣體中是否含水蒸氣的裝置是 AA(填字母)。
(7)若反應過程中產生的氣體全部被D、E吸收,裝置D、E分別增重4.5g、4.4g,則該氣體中一定含有的成分是 CH4、H2CH4、H2。
S
O
2
-
4
S
O
2
-
4
C
u
S
O
4
C
u
S
O
4
△
650
℃
650
℃
△
【考點】鹽的化學性質;分子、原子、離子、元素與物質之間的關系;化學式的書寫及意義;常見氣體的檢驗與除雜方法;單質和化合物的判別;常見的氧化物、酸、堿和鹽的判別;復分解反應發生的條件;有關質量守恒定律的計算;書寫化學方程式、文字表達式、電離方程式;根據化學反應方程式的計算.
【答案】Cu2+、;AE;能;反應產生沉淀;2H2O2 2H2O+O2↑;16.0;CuSO4 CuO+SO3↑;8:1;A;CH4、H2
S
O
2
-
4
C
u
S
O
4
650
℃
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/12/25 12:0:1組卷:243引用:4難度:0.9
相似題
-
1.Na2CO3俗稱純堿,NaOH俗稱燒堿,它們都是白色粉末。請回答下列問題。
(1)能區別Na2CO3和NaOH兩種溶液的方法是(填序號)。
①加入澄清石灰水
②加入食鹽水
③滴入無色酚酞溶液
④加入稀鹽酸
(2)敞口放置的燒堿會吸收空氣中的而變質,反應的化學方程式為。要檢驗NaOH是否變質,可選用的方法是。 (填序號)
①加入澄清石灰水
②加入氯化鈣溶液
③滴入無色酚酞溶液
④加入稀鹽酸
(3)純堿可與CO2和H2O反應生成NaHCO3,該反應的化學方程式為,Na2CO3與稀鹽酸反應放出CO2,但實驗室卻不用這個反應制取CO2,其主要原因可能是;已知在某溫度下,Na2CO3的溶解度比NaHCO3大,則該溫度時,向飽和Na2CO3溶液中連續通入CO2,可觀察到的現象是。發布:2025/1/3 8:0:1組卷:4引用:2難度:0.5 -
2.下列物質不能與氯化鋇溶液發生反應的是( )
A.硫酸銅 B.硝酸銀 C.氯化鈣 D.碳酸鈉 發布:2024/12/25 17:0:2組卷:68引用:3難度:0.5 -
3.蛋白質是組成細胞的基礎物質,沒有蛋白質就沒有生命.人體內的血紅蛋白、各種酶都是蛋白質.一些可溶性的重金屬鹽(如Cu2+、Ba2+、Ag+等的可溶性鹽)與蛋白質作用會使蛋白質凝固變性,從而喪失其生理功能危及生命.因此,可溶性重金屬鹽為有毒物質,根據上述所給知識,用化學式回答下列問題:
(1)CuSO4、AgNO3、Ba(NO3)2、AgCl四種物質中,無毒的是;
(2)在醫療上用X射線檢查胃腸疾病時,讓病人服用硫酸鋇的懸濁液(俗稱鋇餐),而不能服用碳酸鋇,其原因是人體胃液中含有一定量的,與碳酸鋇反應后,產生了一定量的使人中毒的氯化鋇,其反應的化學方程式是.
(3)若因氯化鋇中毒,下列方案中可作為最佳解毒措施的是(填序號).
A、多飲糖水;B、飲用純堿溶液;C、飲用食鹽水;D、飲用硫酸鈉溶液.發布:2024/12/25 17:30:2組卷:48引用:17難度:0.7


