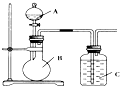
 某同學設計如圖裝置,研究非金屬元素性質變化規律.
某同學設計如圖裝置,研究非金屬元素性質變化規律.
(1)已知硅酸(H2SiO3)是一種難溶于水的弱酸,呈白色.在化學反應中,一般地,強酸能制弱酸,如NaHCO3+HCl═NaCl+CO2↑+H2O,得出:HCl酸性強于H2CO3的酸性.現有硝酸溶液、碳酸鈣、澄清石灰水、硅酸鈉溶液,選擇試劑用如圖裝置證明:酸性:HNO3>H2CO3>H2SiO3.
A中裝試劑硝酸溶液硝酸溶液,B中裝試劑碳酸鈣碳酸鈣.寫出C中發生反應的離子方程式CO2+SiO32-+H2O=H2SiO3↓+CO32-CO2+SiO32-+H2O=H2SiO3↓+CO32-.
(2)已知高錳酸鉀在常溫下與濃鹽酸反應產生氯氣,利用如圖裝置證明氯氣氧化性強于碘單質的氧化性.則A中裝濃鹽酸,B中裝入高錳酸鉀粉末,C中裝試劑淀粉-KI溶液淀粉-KI溶液,寫出離子方程式2I-+Cl2═I2+2Cl-2I-+Cl2═I2+2Cl-.該實驗裝置有明顯不足,請指出改進方法:增加裝有氫氧化鈉溶液的尾氣吸收裝置增加裝有氫氧化鈉溶液的尾氣吸收裝置.
(3)如果C中裝飽和的氫硫酸溶液,A中裝濃鹽酸,B中裝高錳酸鉀溶液,反應開始后觀察到現象是C中產生淡黃色沉淀,寫出化學方程式Cl2+H2S═S↓+2HClCl2+H2S═S↓+2HCl;
證明氯的非金屬性比硫的非金屬性強強(填“強”或“弱”或“無法判斷”).
【答案】硝酸溶液;碳酸鈣;CO2+SiO32-+H2O=H2SiO3↓+CO32-;淀粉-KI溶液;2I-+Cl2═I2+2Cl-;增加裝有氫氧化鈉溶液的尾氣吸收裝置;Cl2+H2S═S↓+2HCl;強
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:112引用:2難度:0.1
相似題
-
1.下列事實不能說明氯的非金屬性強于硫的是( )
A.酸性:HClO3>H2SO3 B.穩定性:HCl>H2S C.3Cl2+2Fe 2FeCl3和S+Fe點燃FeS△D.Cl2+H2S=S↓+2HCl 發布:2024/12/30 18:0:1組卷:24引用:4難度:0.5 -
2.甲、乙兩種非金屬元素:①甲單質比乙單質容易與H2化合;②甲單質能與乙的陰離子發生置換反應;③甲的最高價氧化物對應的水化物酸性比乙的最高價氧化物對應的水化物酸性強;④與某金屬反應時,甲原子得電子數目比乙的多;⑤甲的單質水溶性比乙的強。能說明甲比乙的非金屬性強的是( )
A.④ B.⑤ C.①②③ D.①②③④ 發布:2024/12/30 19:30:2組卷:33引用:3難度:0.8 -
3.碳、氧、硅、鍺、氟、氯、溴、鎳元素在化學中占有極其重要的地位。
(1)第二周期基態原子未成對電子數與Ni相同且電負性最小的元素是。
(2)從電負性角度分析,碳,氧和硅元素的非金屬性由強至弱的順序為。
(3)CH4中共用電子對偏向C,SiH4中共用電子對偏向H,則C、Si、H的電負性由大到小的順序為。
(4)基態鍺(Ge)原子的電子排布式是,Ge的最高價氯化物分子式是。該元素可能的性質或應用有(填字母)。
A.是一種活潑的金屬元素
B.其電負性大于硫
C.其單質可作為半導體材料
D.鍺的第一電離能高于碳而電負性低于碳
(5)溴與氯能以鍵結合形成BrCl,BrCl分子中,顯正電性。BrCl與水發生反應的化學方程式為。發布:2024/12/30 15:30:1組卷:73引用:5難度:0.5


