回答下列問題。
(1)Cu與濃H2SO4發生反應:Cu+2H2SO4(濃) △ CuSO4+SO2↑+2H2O。其中氧化產物是 CuSO4CuSO4,若反應中轉移電子的物質的量為0.2mol,則生成的SO2氣體在標準狀況下的體積為 2.24L2.24L。
(2)下列微粒:①S②S2-③Fe2+④H+⑤Cu⑥HCl⑦H2O在化學反應中只能被氧化的是 ②⑤②⑤(填序號,下同),只能表現出氧化性的是 ④④。
(3)在含有Cu(NO3)2、Mg(NO3)2、AgNO3的混合溶液中加入適量鋅粉,最終反應容器中有固體剩余。則固體中一定含有 AgAg(填化學式),反應后溶液中一定含有的金屬陽離子是 Mg2+、Zn2+Mg2+、Zn2+(填離子符號)。
(4)自來水中的NO-3危害人類健康。為了降低自來水中NO-3的濃度,某研究人員提出兩種方案。
①方案a:微堿性條件下,用Fe(OH)2還原NO-3,產物之一是NH3。生成3.4gNH3的同時會生成 1.61.6molFe(OH)3。
②方案b:堿性條件下,用Al粉還原NO-3,產物之一是N2。發生的反應如下所示,配平后寫出完整的離子方程式并用單線橋標出電子轉移的方向和數目: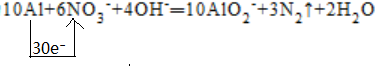
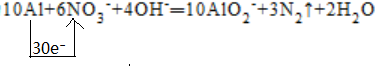
Al+NO-3+OH-→AlO-2+N2↑+H2O。
△
NO
-
3
NO
-
3
NO
-
3
NO
-
3
NO
-
3
A
l
O
-
2
【答案】CuSO4;2.24L;②⑤;④;Ag;Mg2+、Zn2+;1.6;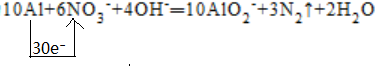
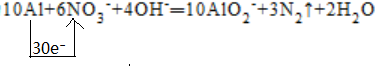
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/10/21 2:0:1組卷:18引用:1難度:0.5
相似題
-
1.將一定量鋅與100mL 18mol/L濃硫酸充分反應后,若鋅完全溶解同時產生氣體0.8mol,將反應后的溶液稀釋得400mL,測得溶液o(H+)=2mol/L,則下列敘述中錯誤的是( )
A.氣體中SO2和H2物質的量比為6:1 B.反應中共消耗鋅52.0g C.所得氣體應該為SO2和H2混合物 D.反應共轉移電子1.6mol 發布:2024/12/30 4:30:1組卷:80引用:5難度:0.4 -
2.已知硫代硫酸鈉可作為脫氯劑,25.0mL0.100mol?L-1的Na2S2O3溶液恰好把224mL(標準狀況下)Cl2轉化為Cl-,則S2
將轉化為( )O2-3A.S2- B.S C. SO2-3D. SO2-4發布:2024/12/30 4:30:1組卷:134引用:5難度:0.5 -
3.向100mL 18mol/L的硫酸溶液中加入足量的銅片并加熱,充分反應后,被還原的硫酸物質的量( )
A.小于0.9 mol B.等于0.9 mol C.在0.9 mol到1.8 mol之間 D.大于1.8 mol 發布:2024/12/30 14:0:1組卷:33引用:2難度:0.9


