離子交換法從海帶中提取碘是一種較為先進的制碘工藝。如圖是使用離子交換樹脂的“離子交換法”從海帶中提取碘的主要流程。
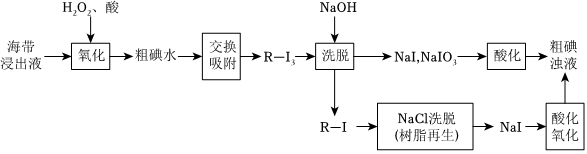
已知:①I2+I-?I-3。
②強堿性陰離子樹脂(用R-Cl表示,Cl-1可被其它更易被吸附的陰離子替代)對多碘離子(I-3)有很強的交換吸附能力。
③步驟“交換吸附”發生的反應:R-Cl+I-3=R-I3+Cl-。
試回答下列問題:
(1)下列各步反應中,屬于氧化還原反應的有:BCBC(填序號)。
A.交換吸附
B.洗脫
C.酸化
D.NaCl洗脫
(2)酸性條件下,原料被H2O2氧化時發生的反應有:
①H2O2+2I-+2H+=I2+2H2OH2O2+2I-+2H+=I2+2H2O;
②I2+I-?I-3。
依據整個生產流程分析是否可以加過量H2O2:否否(填“是”或“否”)。并說明理由:H2O2會I-全部氧化生成I2,無法進行反應I2+I-?I-3,從而導致后續反應無法進行H2O2會I-全部氧化生成I2,無法進行反應I2+I-?I-3,從而導致后續反應無法進行。
(3)實驗室模擬步驟“酸化氧化”,一般選用氯水。工業上生產企業可以按照自己的實際情況,選擇合適的氧化劑。若某企業在酸性條件下選擇NaNO2為氧化劑,反應生成一種無色氣體,遇空氣立即變為紅棕色,則添加氧化劑與NaI的質量比應不少于 23:5023:50。
(4)流程中在NaCl洗脫時離子交換樹脂(表示為R-Cl)可以得到再生,并重復使用,請用離子方程式表示離子交換樹脂再生的原理 R-I+Cl-=R-Cl+I-R-I+Cl-=R-Cl+I-。
I
-
3
I
-
3
I
-
3
H
2
O
2
+
2
I
-
+
2
H
+
=
I
2
+
2
H
2
O
H
2
O
2
+
2
I
-
+
2
H
+
=
I
2
+
2
H
2
O
I
-
3
I
2
+
I
-
?
I
-
3
I
2
+
I
-
?
I
-
3
【考點】從海帶中提取碘.
【答案】BC;;否;H2O2會I-全部氧化生成I2,無法進行反應,從而導致后續反應無法進行;23:50;R-I+Cl-=R-Cl+I-
H
2
O
2
+
2
I
-
+
2
H
+
=
I
2
+
2
H
2
O
I
2
+
I
-
?
I
-
3
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/7/24 8:0:9組卷:49引用:1難度:0.5
相似題
-
1.下列物質的工業制備方案合理的是( )
A.海帶中提碘:海帶灰浸取液 I2H2O2/H+含I2的酒精溶液酒精萃取分液碘單質蒸餾B.由硫黃制硫酸:S SO3O2H2SO4H2OC.海水制鎂:海水 Mg(OH)2Ca(OH)2MgCl2溶液→無水MgCl2鹽酸Mg電解D.鋁土礦制鋁:Al2O3(鋁土礦) NaAlO2NaOHAl(OH)3CO2AlCl3HClAl電解發布:2024/12/21 8:0:2組卷:24引用:1難度:0.5 -
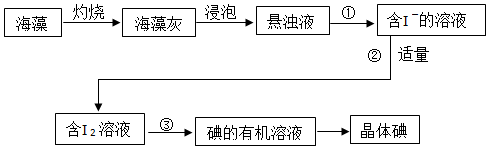
2.海帶中含有豐富的碘元素(以I-形式存在)。實驗中提取碘的流程如圖:
(1)①寫出氯原子的原子結構示意圖: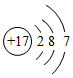
②寫出I-的電子式:
③寫出步驟②發生的離子方程式
(2)①實驗①的操作名稱
②實驗③所需要的主要玻璃儀器為、燒杯。
(3)①實驗操作③中,(填“能”或“不能”)用酒精來提取碘。
②實驗操作③中,若用苯來提取碘,加入少量苯,充分振蕩靜置后的現象是。
A.溶液分層,下層紅棕色
B.溶液分層,上層紅棕色
C.溶液分層,下層紫紅色
D.溶液分層,上層紫紅色
(4)檢驗某無色溶液中是否含有I-,所用試劑不合理的是。
A.淀粉溶液和氯水
B.稀硝酸和硝酸銀溶液
C.氯水和四氯化碳
D.KBr和稀HCl
(5)下列有關從海帶中提取碘的實驗原理和裝置能達到實驗目的是
A.用裝置甲灼燒碎海帶
B.用裝置乙過濾海帶灰的浸泡液
C.用裝置丙制備用于氧化浸泡液中I-的Cl2
D.用裝置丁吸收氧化浸泡液中I-后的Cl2尾氣發布:2024/12/30 8:30:1組卷:54引用:2難度:0.7 -
3.海洋植物如海帶、海藻中含有豐富的碘元素。碘元素以碘離子的形式存在。實驗室里從海藻中提取碘的流程如圖:
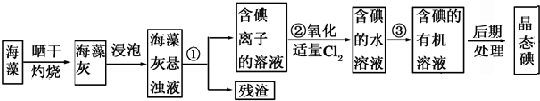
(1)指出制取碘的過程中有關的實驗操作名稱:①。②。
(2)提取碘的過程中。可供選擇的有機試劑是。
A.甲苯、酒精 B.四氯化碳、苯 C.汽油、乙酸 D.汽油、甘油
(3)為使海藻灰中碘離子轉化為碘的有機溶液。實驗室里有燒杯、玻璃棒、集氣瓶、酒精燈、導管、圓底燒瓶、石棉網以及必要的夾持儀器、物品。尚缺少的玻璃儀器是。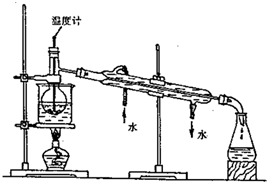
(4)從含碘的有機溶液中提取碘和回收有機溶液。還需要經過蒸餾。觀察右圖實驗裝置指出其錯誤之處。;;(任意說兩點即可)
(5)已知常壓下碘的升華溫度137.2℃,四氯化碳沸點77℃.進行上述蒸餾操作時。使用水浴的原因是。最后晶態碘在里聚集。發布:2024/12/30 13:30:2組卷:89引用:3難度:0.5


