當前位置:
試題詳情
金屬單質(zhì)及其化合物在生產(chǎn)、生活中有著重要用途。某“我與化學”活動興趣小組對鋁和鐵相關物質(zhì)的性質(zhì)和制備做了如圖探究實驗:
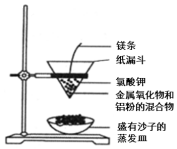
Ⅰ、鋁及其化合物
(1)查閱資料知,鋁單質(zhì)在高溫條件下能體現(xiàn)強還原性,可與某些金屬氧化物反應得到金屬單質(zhì),該反應被稱為鋁熱反應。實驗裝置如圖所示,氯酸鉀為供氧劑,點燃鎂條即可引發(fā)反應。
①該實驗過程中未涉及的基本反應類型有dd。(填序號)
a.化合反應
b.分解反應
c.置換反應
d.復分解反應
②若金屬氧化物為四氧化三鐵,該鋁熱反應的方程式為:8Al+3Fe3O4 高溫 4Al2O3+9Fe8Al+3Fe3O4 高溫 4Al2O3+9Fe。
(2)該小組用鋁粉、1.00mol/L H2SO4、1.00mol/L NaOH溶液,分別采用兩種不同方案制備氫氧化鋁(假設以下各實驗方案中每一步都是恰好完全反應):
方案一:mg鋁粉1.00mol/LH2SO4Al2(SO4)3溶液1.00mol/LNaOHAl(OH)3
方案二:mg鋁粉1.00mol/LNaOHNaAlO2溶液1.00mol/LH2SO4Al(OH)3
①方案一可制取氫氧化鋁的質(zhì)量為26m926m9g(用含m的式子表示),兩種不同方案制取得氫氧化鋁的質(zhì)量cc。(填選項)
a.方案一多
b.方案二多
c.一樣多
d.無法比較
實驗發(fā)現(xiàn),硫酸鋁溶液和偏鋁酸鈉溶液混合后,會立即生成氫氧化鋁沉淀。查閱資料可知反應如下:Al3++3AlO2-+6H2O═4Al(OH)3↓,該小組同學根據(jù)該反應原理,又設計了制備氫氧化鋁的第三種方案:
方案三: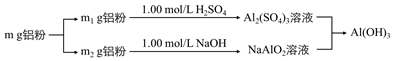
②若使鋁粉得到充分利用,以得到最大質(zhì)量的Al(OH)3,則m1:m2=1:31:3。
③三種不同方案,所用1.00mol/L H2SO4溶液的體積分別為:方案一xmL、方案二ymL、方案三zmL,則x:y:z=12:4:312:4:3。(用最簡整數(shù)比表示)
Ⅱ、鐵及其化合物
(3)向FeSO4溶液中滴加NaOH溶液,產(chǎn)生白色沉淀,但迅速變?yōu)榛揖G色,最終變?yōu)榧t褐色,沉淀由白色變?yōu)榧t褐色的反應化學方程式為:4Fe(OH)2+O2+2H2O=4Fe(OH)34Fe(OH)2+O2+2H2O=4Fe(OH)3。
(4)為順利觀察到較長時間的白色沉淀,設計了如圖所示裝置:
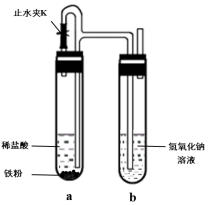
①檢查裝置氣密性,裝入藥品;②打開止水夾K;③在試管b出口收集氣體并驗純;④關閉水夾K。以上操作正確的順序是:①②③④①②③④,
(5)為證明FeSO4溶液是否發(fā)生了部分氧化而變質(zhì),提出如下實驗思路:
①證明已經(jīng)發(fā)生了氧化:需要的試劑是KSCN溶液KSCN溶液;②證明沒有完全氧化:需要的試劑是酸性高錳酸鉀溶液酸性高錳酸鉀溶液。
高溫
高溫
1
.
00
mol
/
L
H
2
S
O
4
1
.
00
mol
/
LN
a
OH
1
.
00
mol
/
LN
a
OH
1
.
00
mol
/
L
H
2
S
O
4
26
m
9
26
m
9
【答案】d;8Al+3Fe3O4 4Al2O3+9Fe;;c;1:3;12:4:3;4Fe(OH)2+O2+2H2O=4Fe(OH)3;①②③④;KSCN溶液;酸性高錳酸鉀溶液
高溫
26
m
9
【解答】
【點評】
聲明:本試題解析著作權屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復制發(fā)布。
發(fā)布:2024/12/6 8:0:2組卷:58引用:1難度:0.6
相似題
-
1.“鋁熱反應”是一種重要的化學反應,下列說法正確的是( )
A.是吸熱反應 B.鋁熱劑是純凈物 C.鋁熱劑是混合物 D.鋁熱反應不是氧化還原反應 發(fā)布:2025/1/21 8:0:1組卷:48引用:1難度:0.9 -
 2.按要求回答下列問題:
2.按要求回答下列問題:
(1)實驗室鋁粉和Fe2O3作鋁熱反應實驗,鋁熱反應的方程式為,該實驗中除用到鋁粉和Fe2O3外,需要的試劑還有(填編號).
a.KClO3 b.Mg c.MnO2 d.KCl
(2)據(jù)文獻報道,在實際反應中鋁熱反應的產(chǎn)物成分較為復雜.某課題組對鋁熱反應產(chǎn)物的成分進行探究,經(jīng)成分分析,發(fā)現(xiàn)主要得到甲和乙兩種產(chǎn)物.甲由具有相同電子層結構的陰、陽離子構成;乙是一種鐵鋁的金屬互化物(可用FexAly表示),取該合金粉末2.47g,滴加足量濃NaOH溶液,充分攪拌、過濾、洗滌得固體.再將所得固體在空氣中充分加熱、灼燒得紅棕色粉末1.60g.
①甲的化學式為,乙中x=,y=.
②甲的晶體是耐高溫材料,用此材料做成的坩堝,不能用來熔融NaOH,用化學方程式解釋其原因;
含二氧化硅材料做成的坩堝(填“能”或“不能”)用來熔融NaOH.
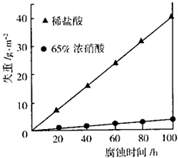
③如圖表示室溫下相同組分的乙分別在兩種不同的酸中的腐蝕情況,由圖可知,乙在中具有比較強的抗腐蝕性,原因可能是.
④研究發(fā)現(xiàn)鋁熱反應后期溫度高達2000℃以上時會有極微量的Al4C3生成,Al4C3遇水會產(chǎn)生一種氣體,該氣體的分子式為.[已知CaC2+2H2O═Ca(OH)2+C2H2↑]
(3)鎂鋁互化物(Mg17Al12)是一種潛在的貯氫材料,該金屬互化物在一定條件下完全吸氫的反應方程式為Mg17Al12+17H2═17MgH2+12Al.得到的混合物在6.0mol?L-1HCl中,能完全釋放出H2.1mol Mg17Al12完全吸氫后得到的混合物與上述鹽酸完全反應,釋放出H2的物質(zhì)的量為.發(fā)布:2024/12/6 8:0:2組卷:24引用:1難度:0.3 -
3.下列關于鋁熱反應的說法錯誤的是( )
A.鋁熱反應中的還原劑是鋁粉 B.鋁熱劑是純凈物 C.鋁與Fe2O3可組成鋁熱劑 D.鋁熱反應是放熱反應 發(fā)布:2025/1/21 8:0:1組卷:13引用:3難度:0.6


