按要求回答下列問題:
(1)拆開1mol共價鍵所吸收的能量或形成1mol共價鍵所釋放的能量稱為鍵能。利用下表數(shù)據(jù),計算生成1molHCl能 放出放出(填“吸收”或“放出”) 91.591.5kJ熱量。
| 化學(xué)鍵 | H-H | Cl-Cl | H-Cl |
| 鍵能/kJ?mol-1 | 436 | 243 | 431 |

①當(dāng)外電路轉(zhuǎn)移2mole-時,消耗的氧氣體積在標(biāo)準(zhǔn)狀況下為
22.4
22.4
L;②電極b的電極反應(yīng)式為.
CO+O2--2e-=CO2
CO+O2--2e-=CO2
。(3)工業(yè)上利用CO2和H2合成甲醇,催化反應(yīng)為3H2(g)+CO2(g)?CH3OH(g)+H2O(g),在一恒溫恒容密閉容器中充入3molH2和1molCO2進(jìn)行上述反應(yīng),測得CO2(g)和CH3OH(g)濃度隨時間變化如圖。

①從0min到3min,v(H2)=
0.75
0.75
mol?L-1?min-1。②反應(yīng)前的壓強(qiáng)與平衡時的壓強(qiáng)之比為
8:5
8:5
。③下列表述正確的是
BC
BC
(填字母)。A.第3分鐘時v正(CH3OH)小于第10分鐘時v逆(CH3OH)
B.混合氣體的平均相對分子質(zhì)量不隨時間的變化而變化,反應(yīng)達(dá)到平衡狀態(tài)
C.達(dá)到平衡時CO2的轉(zhuǎn)化率為75%
D.平衡混合氣體中CO2(g)和H2(g)的質(zhì)量之比是22:1
【答案】放出;91.5;22.4;CO+O2--2e-=CO2;0.75;8:5;BC
【解答】
【點評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/4/20 14:35:0組卷:3引用:1難度:0.5
相似題
-
1.德國化學(xué)家哈伯(F.Haber)從1902年開始研究由氮?dú)夂蜌錃庵苯雍铣砂薄9I(yè)合成氨為解決世界的糧食問題做出了重要貢獻(xiàn),其原理為N2(g)+3H2(g)?2NH3(g)ΔH=-92.4kJ?mol-1。若已知H-H鍵的鍵能為436.0kJ?mol-1,N-H的鍵能為390.8kJ?mol-1,則N≡N的鍵能約為
kJ?mol-1。發(fā)布:2024/12/30 19:0:1組卷:0引用:3難度:0.7 -
2.已知:
則乙苯催化脫氫制苯乙烯:化學(xué)鍵 C-H C-C C=C H-H 鍵能/kJ?mol ̄1 412 348 612 436  的反應(yīng)熱為( )
的反應(yīng)熱為( )A.+124 kJ/mol B.+246 kJ/mol C.+368 kJ/mol D.+429 kJ/mol 發(fā)布:2024/12/30 18:0:1組卷:19引用:2難度:0.9 -
3.氫氣是一種清潔能源,也是一種重要的工業(yè)原料.
(1)氫氣既能與氮?dú)庥帜芘c氧氣發(fā)生反應(yīng),但是反應(yīng)的條件卻不相同.
已知:2H2(g)+O2(g)=2H2O (g)ΔH=-483.6kJ/mol
3H2 (g)+N2(g)?2NH3(g)ΔH=-92.4kJ/mol
計算斷裂1mol N≡N鍵需要能量kJ,氮?dú)夥肿又谢瘜W(xué)鍵比氧氣分子中的化學(xué)鍵鍵(填“強(qiáng)”或“弱”),因此氫氣與二者反應(yīng)的條件不同.
(2)氫氣是工業(yè)合成氨的原料氣,而氨氣可用于合成硝酸.已知:N2(g)+O2(g)=2NO (g)ΔH=+180.8kJ/mol,寫出氨氣與氧氣反應(yīng)生成一氧化氮和氣態(tài)水的熱化學(xué)方程式.
(3)據(jù)報道,科學(xué)家在實驗室已研制出在燃料電池的反應(yīng)容器中,利用特殊電極材料以H2
和O2為原料制取過氧化氫的新工藝.原理如圖2所示.請寫出甲電極的電極反應(yīng)式.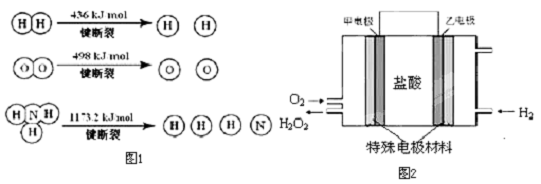 發(fā)布:2024/12/30 14:30:1組卷:9引用:3難度:0.1
發(fā)布:2024/12/30 14:30:1組卷:9引用:3難度:0.1
相關(guān)試卷


