回答下列問題:
(1)t℃時,水的Kw=1×10-12,則該溫度 >>(填“>”“<”或“=”)25℃,其理由是 升高溫度會促進水的電離使Kw增大升高溫度會促進水的電離使Kw增大。
(2)在(1)中所述溫度下,c(H+)=1×10-7mol?L-1的溶液呈 堿性堿性(填“酸性”“堿性”或“中性”);若該溶液中只存在NaOH溶質,則由水電離出的c(OH-)=1.0×10-71.0×10-7mol?L-1。
(3)實驗室用Zn和稀硫酸制取H2,反應時溶液中水的電離平衡 向右向右(填“向左”“向右”或“不”,下同)移動。在新制氯水中加入少量NaCl固體,水的電離平衡 向右向右移動。
(4)25℃時,pH=4的鹽酸中水的電離程度 等于等于(填“大于”“小于”或“等于”)pH=10的Ba(OH)2溶液中水的電離程度。
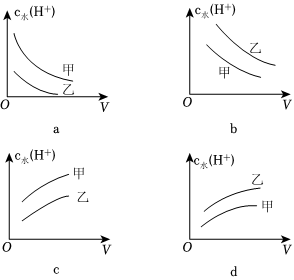
(5)0.1mol?L-1乙酸(甲,Ka=1.75×10-5)和0.1mol?L-1氯乙酸(乙,Ka=1.4×10-3)的水溶液,下列可以表示兩溶液中由水電離出的c水(H+)與加入水的體積V之間關系的是 cc(填序號)。
(6)下列操作合理的是 ADAD(填字母)。
A.用25mL堿式滴定管量取20.00mLNaHCO3溶液
B.用托盤天平準確稱量10.20g碳酸鈉固體
C.用100mL量筒量取3.2mL濃硫酸
D.配制1mol?L-1的氫氧化鈉溶液495.5mL用500mL容量瓶
(7)某學生欲用已知物質的量濃度的鹽酸來測定未知物質的量濃度的氫氧化鈉溶液,由于錯誤操作,使得上述所測氫氧化鈉溶液的濃度偏高的是 CDCD(填字母)。
A.中和滴定到達終點時俯視滴定管內液面讀數
B.堿式滴定管用蒸餾水洗凈后立即取用25.00mL待測堿溶液注入錐形瓶進行滴定
C.酸式滴定管用蒸餾水洗凈后立即裝標準溶液來滴定
D.把配好的標準溶液倒入剛用蒸餾水洗凈的試劑瓶中然后用來滴定
【答案】>;升高溫度會促進水的電離使Kw增大;堿性;1.0×10-7;向右;向右;等于;c;AD;CD
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:21引用:2難度:0.6
相似題
-
1.下列物質溶解于水時,電離出的陽離子能使水的電離平衡向右移動的是( )
A.NH4Cl B.CH3COONa C.H2SO4 D.KNO3 發布:2024/12/5 20:30:2組卷:42引用:2難度:0.8 -
2.25℃時水的電離達到平衡:H2O?H++OH-ΔH>0,下列敘述不正確的是( )
A.將水加熱,Kw增大,pH減小 B.向水中加入少量硫酸氫鈉固體, 增大c(H+)c(OH-)C.在蒸餾水中滴加濃H2SO4,Kw不變,c(H+)增大 D.向水中滴入少量NaOH溶液,平衡逆向移動,c(H+)降低 發布:2024/12/10 10:30:1組卷:246引用:5難度:0.7 -
3.下列關于水的電離H2O?H++OH-ΔH>0的說法不正確的是( )
A.將水加熱至50℃,水的電離平衡正向移動,水依然呈中性 B.向水中加入少量NaOH,水的電離平衡逆向移動,溶液呈堿性 C.向水中加入少量NH4Cl,水的電離平衡正向移動,溶液呈酸性 D.常溫下,pH=2的鹽酸中,水電離的c(H+)=1.0×10-2mol?L-1 發布:2024/12/30 3:30:1組卷:93引用:6難度:0.8


