用化學方法進行環境修復已成為環境修復領域的重要研究方向。
(1)O3能將NO和NO2轉化成綠色硝化劑N2O5。已知下列熱化學方程式:
2N2O5(g)═4NO2(g)+O2(g)ΔH=+106.2kJ?mol-1
2NO(g)+O2(g)═2NO2(g)ΔH=-114kJ?mol-1
2O3(g)═3O2(g)ΔH=-284.2kJ?mol-1
則反應2NO(g)+2NO2(g)+2O3(g)═2N2O5(g)+O2(g)的ΔH=+504.4kJ/mol+504.4kJ/mol。
(2)納米零價鐵(ZVI)因其高比表面積、優異的吸附性、較強的還原性和反應活性等優點被廣泛應用于污染物的去除。
①ZVI可通過FeCl2?4H2O和NaBH4溶液反應得,同時生成H2、B(OH)4-,制備過程中需要不斷通入高純氨氣,其目的是 排除裝置中存在的空氣,防止制得的納米零價鐵被氧化;及時排出H2,防止爆炸排除裝置中存在的空氣,防止制得的納米零價鐵被氧化;及時排出H2,防止爆炸。
②ZVI電化學腐蝕處理三氯乙烯進行水體修復,H+、O2、NO-3等物種的存在會影響效果,水體修復的過程如圖-1所示。有效腐蝕過程中,生成1mol乙烯所轉移電子的物質的量為 66mol,過程d對應的電極反應式為 NO-3+10H++8e-=NH+4+3H2ONO-3+10H++8e-=NH+4+3H2O。
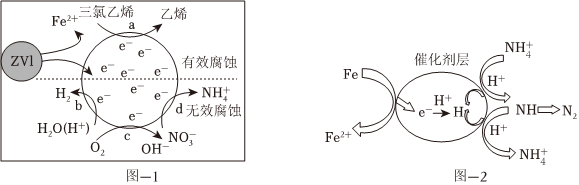
(3)催化劑協同ZVI能將水體中的硝酸鹽(NO-3)轉化為N2,其催化還原反應的過程如圖-2所示。
①硝酸鹽(NO-3)轉化為N2示意圖可以描述為 納米零價鐵在催化劑表面失去電子變為亞鐵離子,在催化劑層中氫離子得到電子變為氫原子,在酸性條件下氫原子還原硝酸根變為NH,NH失去氫原子變為氮氣納米零價鐵在催化劑表面失去電子變為亞鐵離子,在催化劑層中氫離子得到電子變為氫原子,在酸性條件下氫原子還原硝酸根變為NH,NH失去氫原子變為氮氣。
②為有效降低水體中氮元素的含量,宜調整水體pH為4.2,當pH<4.2時,隨pH減小,N2生成率逐漸降低的原因是 pH減小,H+濃度增大,會生成更多的H,使NO-3被還原的中間產物NH更多的與H 反應生成NH+4,減少N2的生成pH減小,H+濃度增大,會生成更多的H,使NO-3被還原的中間產物NH更多的與H 反應生成NH+4,減少N2的生成。
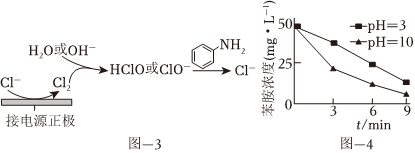
(4)利用電化學裝置通過間接氧化法能氧化含苯胺的污水,其原理如圖-3所示。其他條件一定,測得不同初始pH條件下,溶液中苯胺的濃度與時間的關系如圖-4所示。反應相同時間,初始溶液pH=3時苯胺濃度大于pH=10時的原因是 酸性條件下Cl2不易與水反應生成HClO,pH=3時的溶液中HClO溶液濃度遠小于pH=10時的ClO-濃度,反應速率較慢酸性條件下Cl2不易與水反應生成HClO,pH=3時的溶液中HClO溶液濃度遠小于pH=10時的ClO-濃度,反應速率較慢。[已知氧化性:HClO(H+)>ClO-(OH-)]
NO
-
3
NO
-
3
NH
+
4
NO
-
3
NH
+
4
NO
-
3
NO
-
3
NO
-
3
NH
+
4
NO
-
3
NH
+
4
【答案】+504.4kJ/mol;排除裝置中存在的空氣,防止制得的納米零價鐵被氧化;及時排出H2,防止爆炸;6;+10H++8e-=+3H2O;納米零價鐵在催化劑表面失去電子變為亞鐵離子,在催化劑層中氫離子得到電子變為氫原子,在酸性條件下氫原子還原硝酸根變為NH,NH失去氫原子變為氮氣;pH減小,H+濃度增大,會生成更多的H,使被還原的中間產物NH更多的與H 反應生成,減少N2的生成;酸性條件下Cl2不易與水反應生成HClO,pH=3時的溶液中HClO溶液濃度遠小于pH=10時的ClO-濃度,反應速率較慢
NO
-
3
NH
+
4
NO
-
3
NH
+
4
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:59引用:1難度:0.3
相似題
-
 1.第五主族的磷單質及其化合物在工業上有廣泛應用.
1.第五主族的磷單質及其化合物在工業上有廣泛應用.
(1)同磷灰石在高溫下制備黃磷的熱化學方程式為:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H已知相同條件下:4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H12Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g)△H2SiO2(s)+CaO(s)=CaSiO3(s)△H3用△H1、△H2和△H3表示△H,則△H=;
(2)白磷與氧氣反應生成P4O10固體.已知斷裂下列化學鍵需要吸收的能量分別為:P-P a kJ?mol-1、P-O b kJ?mol-1、P═O c kJ?mol-1、O═O d kJ?mol-1.根據圖1的分子結構和有關數據通過計算寫出該反應的熱化學方程式為.
(3)三聚磷酸可視為三個磷酸分子(磷酸結構式如圖2)之間脫去兩個水分子產物,其結構式為,三聚磷酸鈉(俗稱“五鈉”)是常用的水處理劑,其化學式為.
(4)次磷酸(H3PO2)為一元酸,分子中含一個羥基,其鈉鹽的正鹽的化學式為,該鹽可用于工業上的化學鍍鎳.①化學鍍鎳的溶液中含有Ni2+和H2PO2-,在酸性等條件下發生下述反應:
(a)□Ni2++□H2PO2-+□=□Ni++□H2PO3-+□
(b)6H2PO-2+2H+=2P+4H2PO3-+3H2↑請在答題卡上寫出并配平反應式(a);
②利用①中反應可在塑料鍍件表面沉積鎳-磷合金,從而達到化學鍍鎳的目的,這是一種常見的化學鍍.請從以下方面比較化學鍍與電鍍.原理上的不同點:;化學鍍的優點:.發布:2024/11/19 8:0:1組卷:77引用:2難度:0.1 -
2.已知在1200℃時,天然氣脫硫工藝中會發生下列反應:
①H2S(g)+O2(g)═SO2(g)+H2O(g) ΔH132
②2H2S(g)+SO2(g)═S2(g)+2H2O(g) ΔH232
③H2S(g)+O2(g)═S(g)+H2O(g) ΔH312
④2S(g)═S2(g) ΔH4
則ΔH4的正確表達式為( )A.ΔH4= (ΔH1+ΔH2-3ΔH3)23B.ΔH4= (3ΔH3-ΔH1-ΔH2)23C.ΔH4= (ΔH1+ΔH2-3ΔH3)32D.ΔH4= (ΔH1-ΔH2-3ΔH3)32發布:2024/12/6 13:30:1組卷:392引用:6難度:0.5 -
3.氨和聯氨(N2H4)是氮的兩種常見化合物,在科學技術和生產中有重要的應用.聯氨(又稱肼,N2H4或H2N-NH2,無色液體)是一種應用廣泛的化工原料,可用作火箭燃料.回答下列問題:
(1)聯氨分子的電子式為,其中氮的化合價為;
(2)實驗室中可用次氯酸鈉溶液與氨反應制備聯氨,該反應中還原劑與氧化劑的物質的量之比為2:1,反應的化學方程式為.
(3)①2O2(g)+N2(g)═N2O4(g)△H1
②ON2(g)+2H2(g)═N2H4(l)△H2
③O2(g)+2H2(g)═2H2O(g)△H3
④N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H4=-1038.6kJ?mol-1
上述反應熱效應之間的關系式為△H4=,聯氨和N2O4可作為火箭推進劑的主要原因為.
(4)聯氨可用作火箭燃料,燃燒時發生的反應是N2O4(l)+2N2O4(l)═3N2(g)+4H2O(g)△H=-1038.6kJ?mol-1,若該反應中有4molN-H鍵斷裂,則反應放出的熱量為kJ.發布:2024/11/18 8:0:1組卷:12引用:0難度:0.9


