某化學實驗小組的同學利用銅與濃硫酸反應制取二氧化硫并研究其性質,所用實驗裝置如圖:

回答下列問題:
(1)將銅絲下端卷成螺旋狀的理由是 增大Cu與濃硫酸的接觸面積,加快反應速率快增大Cu與濃硫酸的接觸面積,加快反應速率快。
(2)向外拉銅絲,終止反應,冷卻后,進一步證明A裝置試管中反應所得產物含有銅離子的操作是 將A裝置試管內的物質沿器壁慢慢倒入盛有水的燒杯(或試管)中,觀察到溶液變藍將A裝置試管內的物質沿器壁慢慢倒入盛有水的燒杯(或試管)中,觀察到溶液變藍。
(3)用化學方程式表示氫氧化鈉溶液的作用是 SO2+2NaOH=Na2SO3+H2OSO2+2NaOH=Na2SO3+H2O。
(4)裝置A中反應的化學方程式是 Cu+2H2SO4(濃) 加熱 CuSO4+SO2↑+2H2OCu+2H2SO4(濃) 加熱 CuSO4+SO2↑+2H2O。
(5)裝置B和裝置C分別驗證了二氧化硫的 還原性、氧化性還原性、氧化性性質。
(6)化學實驗小組的同學發現試管中有黑色物質產生,猜測黑色物質中可能含有CuO、Cu2S和CuS,針對產生的黑色物質,該小組同學利用裝置A用不同濃度的濃硫酸與銅反應繼。續實驗探究,并獲得數據如表。下列說法錯誤的是 BCBC(填字母)。已知:Cu2S、CuS不溶于稀硫酸。
加熱
加熱
| 硫酸濃度/(mol?L-1) | 黑色物質出現的溫度/°C | 黑色物質消失的溫度/°C |
| 15 | 約150 | 約236 |
| 16 | 約140 | 約250 |
| 18 | 約120 | 不消失 |
B.黑色物質消失過程中有SO2、H2S生成
C.相同條件下,硫酸濃度越大,反應速率越快,黑色物質越易出現、越易消失
D.硫酸濃度為16mol/L時,先升溫至250℃以上,再將銅絲與濃硫酸接觸,可以避免產生黑色物質
【考點】濃硫酸的性質實驗.
【答案】增大Cu與濃硫酸的接觸面積,加快反應速率快;將A裝置試管內的物質沿器壁慢慢倒入盛有水的燒杯(或試管)中,觀察到溶液變藍;SO2+2NaOH=Na2SO3+H2O;Cu+2H2SO4(濃) CuSO4+SO2↑+2H2O;還原性、氧化性;BC
加熱
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:74引用:2難度:0.6
相似題
-
1.下列依據實驗方案和現象對濃硫酸性質做出的判斷合理的是( )
實驗方案 實驗I: 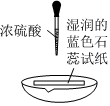
實驗Ⅱ: 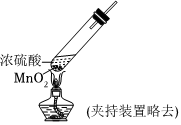
實驗現象 試紙中心區域變黑,邊緣變紅 黑色固體溶解,溶液接近無色(溶液中錳元素僅以Mn2+存在),產生能使帶火星的木條復燃的無色氣體 A.由Ⅰ可知,濃硫酸具有脫水性 B.由Ⅰ可知,濃硫酸具有弱酸性 C.由Ⅱ可知,濃硫酸具有強氧化性 D.由Ⅱ可知,濃硫酸具有吸水性 發布:2024/12/30 11:30:1組卷:167引用:6難度:0.5 -
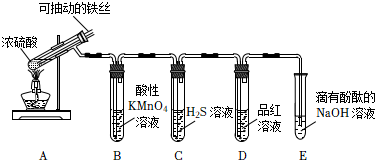 2.實驗室為探究鐵與足量濃硫酸的反應,并驗證SO2的性質,設計如圖所示裝置進行實驗,下列說法錯誤的是( )
2.實驗室為探究鐵與足量濃硫酸的反應,并驗證SO2的性質,設計如圖所示裝置進行實驗,下列說法錯誤的是( )A.實驗結束后,可取A中試管內的溶液稀釋后滴加KSCN溶液檢驗是否有Fe3+ B.B中溶液紫色褪去,C中生成淡黃色沉淀,均體現了SO2的還原性 C.D中品紅溶液褪色,體現了SO2的漂白性 D.E中溶液紅色變淺,體現了SO2酸性氧化物的性質 發布:2024/12/30 14:0:1組卷:112引用:3難度:0.7 -
3.某小組同學探究濃硫酸的性質,向試管①、②中加入等量的98%的濃硫酸,實驗如下。下列對實驗的分析不合理的是( )
實驗1 實驗2 實驗3 裝置 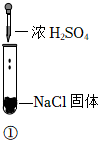
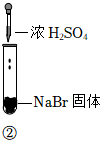
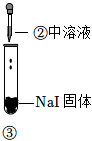
現象 溶液顏色無明顯變化;把蘸濃氨水的玻璃棒靠近試管口,產生白煙 溶液變黃;把濕潤的品紅試紙靠近試管口,試紙褪色 溶液變深紫色(經檢驗溶液含單質碘) A.實驗1中,白煙是NH4Cl B.根據實驗1和實驗2判斷還原性:Br->Cl- C.根據實驗3判斷還原性:I->Br- D.上述實驗體現了濃H2SO4的強氧化性、難揮發性等性質 發布:2024/12/30 7:30:1組卷:190引用:5難度:0.7


