現有下列10種物質:①鐵②H3PO4③Ba(OH)2溶液④濃鹽酸⑤氨氣⑥KClO3固體⑦熔融的NaCl⑧NaHSO4固體⑨高錳酸鉀粉末⑩氫氧化鐵膠體。回答下列問題:
(1)上述物質中能導電的有 ①③④⑦⑩①③④⑦⑩(填序號,下同);屬于電解質的有 ②⑥⑦⑧⑨②⑥⑦⑧⑨。
(2)NaCl不但是日常生活中的調味品,也是一種重要的工業原料;工業上常采用電解飽和食鹽水的方法生產NaOH,同時得到兩種副產品H2和Cl2,寫出電解飽和食鹽水的離子方程式:2Cl-+2H2O 通電 2OH-+H2↑+Cl2↑2Cl-+2H2O 通電 2OH-+H2↑+Cl2↑。
(3)NaHSO4在熔融時的電離方程式為:NaHSO4(熔融)=Na++HSO-4NaHSO4(熔融)=Na++HSO-4;
將Ba(OH)2溶液逐滴加入NaHSO4溶液中至溶液呈中性,反應的離子方程式為 2H++2OH-+Ba2++SO2-4=BaSO4↓+2H2O2H++2OH-+Ba2++SO2-4=BaSO4↓+2H2O。
(4)KClO3和濃鹽酸在一定溫度下反應會生成黃綠色的易爆物二氧化氯。其變化可表示為:2KClO3+4HCl(濃)=2KCl+2ClO2↑+Cl2↑+2H2O,
①請用“雙線橋”表示上述反應電子轉移的方向和數目 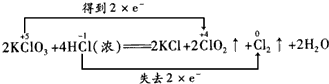
 。
。
②濃鹽酸在反應中顯示出來的性質是 BB。
A.只有還原性
B.還原性和酸性
C.只有氧化性
D.氧化性和酸性
(5)H3PO4是三元弱酸,磷還有一種含氧酸叫亞磷酸(H3PO3),它是一種二元弱酸,則Na2HPO3為 正鹽正鹽(填“正鹽”或“酸式鹽”),寫出H3PO3與足量NaOH溶液反應的化學方程式 H3PO3+2NaOH=Na2HPO3+2H2OH3PO3+2NaOH=Na2HPO3+2H2O。
通電
通電
HSO
-
4
HSO
-
4
SO
2
-
4
SO
2
-
4


【答案】①③④⑦⑩;②⑥⑦⑧⑨;2Cl-+2H2O 2OH-+H2↑+Cl2↑;NaHSO4(熔融)=Na++;2H++2OH-+Ba2++=BaSO4↓+2H2O; ;B;正鹽;H3PO3+2NaOH=Na2HPO3+2H2O
;B;正鹽;H3PO3+2NaOH=Na2HPO3+2H2O
通電
HSO
-
4
SO
2
-
4
 ;B;正鹽;H3PO3+2NaOH=Na2HPO3+2H2O
;B;正鹽;H3PO3+2NaOH=Na2HPO3+2H2O【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/9/18 2:0:8組卷:7引用:1難度:0.7
相似題
-
1.下列說法正確的是( )
A.H2、D2、T2互稱為同位素 B.漂白粉、氯水是混合物,水銀、明礬是純凈物 C.HCl、NH3、BaSO4是電解質,CO2、Cl2、CH3CH2OH是非電解質 D.水能、風能、煤、石油、天然氣都是可再生能源 發布:2025/1/4 8:0:1組卷:8引用:1難度:0.9 -
2.下列物質屬于電解質的是( )
①NaOH ②BaSO4 ③Cu ④蔗糖 ⑤CO2.A.①② B.①②⑤ C.③④ D.①⑤ 發布:2025/1/6 6:0:5組卷:18引用:6難度:0.9 -
3.食鹽、蔗糖、醋酸、純堿、“84”消毒液等是居民經常使用的物質,下列有關說法不正確的是( )
A.蔗糖是非電解質 B.醋酸中存在CH3COOH分子 C.固體純堿能導電 D.“84”消毒液中的有效成分NaClO是強電解質 發布:2025/1/6 6:0:5組卷:3引用:1難度:0.8


