硝酸銨鈣晶體[5Ca(NO3)2?NH4NO3?10H2O]極易溶于水,是一種綠色的復合肥料.
(1)硝酸銨鈣晶體的溶液顯酸性,原因是 NH4++H2O?NH3?H2O+H+NH4++H2O?NH3?H2O+H+(用離子方程式表示).
(2)已知磷酸鈣是一種難溶物,常溫下,其Ksp=2.0×10-33,2≈1.414.工業上生產硝酸銨鈣的方法是以硝酸浸取磷礦石得到的粗硝酸鈣(含硝酸鈣、磷酸鈣及硝酸)為原料制備,其生產流程如下:

①在粗硝酸鈣濁液中,c(Ca2+)≈0.1mol/L,則其中c(PO43-)約為 1.414×10-15mol/L1.414×10-15mol/L.
②加入適量的碳酸鈣后發生反應的離子方程式為 CaCO3+2H+═Ca2++CO2↑+H2OCaCO3+2H+═Ca2++CO2↑+H2O.
③硝酸銨是一種易分解的物質,保存和利用時,需控制在較低溫度.230~400℃時,它會分解成空氣中含量最大的兩種氣體,其反應的化學方程式為 2NH4NO3 230~400℃ 2N2↑+O2↑+4H2O2NH4NO3 230~400℃ 2N2↑+O2↑+4H2O.
(3)生產硝酸銨鈣工廠的廢水中常含有硝酸銨,凈化方法有反硝化凈化法和電解法.
①NO3-在酸性條件下可轉化為N2,該反硝化方法可用半反應(同電極反應式)表示 2NO3-+10e-+12H+═6H2O+N2↑2NO3-+10e-+12H+═6H2O+N2↑.
②目前常用電解法凈化,工作原理如圖所示(陽膜和陰膜分別只允許陽離子、陰離子通過);

Ⅰ.陽極的電極反應為 2H2O-4e-═4H++O2↑2H2O-4e-═4H++O2↑,Ⅰ室可回收的產品為 硝酸硝酸(填名稱).
Ⅱ.Ⅲ室可回收到氨氣,請結合方程式和文字解釋其原因 電解時Ⅲ室氫離子得電子發生還原反應(或2H++2e-=H2),使堿性增強,同時NH4+通過陽離子膜進入III室,發生反應:NH4++OH-=NH3+H2O,生成氨氣電解時Ⅲ室氫離子得電子發生還原反應(或2H++2e-=H2),使堿性增強,同時NH4+通過陽離子膜進入III室,發生反應:NH4++OH-=NH3+H2O,生成氨氣.
2
230
~
400
℃
230
~
400
℃
【考點】制備實驗方案的設計.
【答案】NH4++H2O?NH3?H2O+H+;1.414×10-15mol/L;CaCO3+2H+═Ca2++CO2↑+H2O;2NH4NO3 2N2↑+O2↑+4H2O;2NO3-+10e-+12H+═6H2O+N2↑;2H2O-4e-═4H++O2↑;硝酸;電解時Ⅲ室氫離子得電子發生還原反應(或2H++2e-=H2),使堿性增強,同時NH4+通過陽離子膜進入III室,發生反應:NH4++OH-=NH3+H2O,生成氨氣
230
~
400
℃
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:7引用:2難度:0.5
相似題
-
1.硫鐵礦燒渣是硫鐵礦生產硫酸過程中產生的工業廢渣(主要含Fe2O3及少量SiO2、Al2O3等雜質).用該燒渣制取藥用輔料--紅氧化鐵的工藝流程如下:
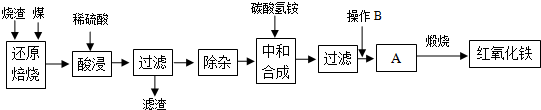
(1)在“還原焙燒”中產生的有毒氣體可能有.
(2)“酸浸”時間一般不超過20min,若在空氣中酸浸時間過長,溶液中Fe2+含量將下降,其原因是(用離子方程式表示).
(3)根據下表數據:
在“除雜”步驟中,為除去Fe3+和Al3+,溶液的pH最大值應小于氫氧化物 Al(OH)3 Fe(OH)3 Fe(OH)2 開始沉淀的pH 3.10 2.01 7.11 完全沉淀的pH 4.77 3.68 9.61 ,檢驗
Fe3+已經除盡的試劑是.
(4)“中和合成”的目的是將溶液中Fe2+轉變為碳酸亞鐵沉淀,則操作B是.
(5)煅燒A的反應方程式是.
(6)a g燒渣經過上述工藝可得紅氧化鐵b g.藥典標準規定,制得的紅氧化鐵中含氧化鐵不得少于98.0%,則所選用的燒渣中鐵的質量分數應不低于(用含a、b的表達式表示).發布:2025/1/19 8:0:1組卷:5引用:1難度:0.5 -
2.硫鐵礦燒渣是硫鐵礦生產硫酸過程中產生的工業廢渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等雜質).用該燒渣制取藥用輔料--紅氧化鐵的工藝流程如圖:
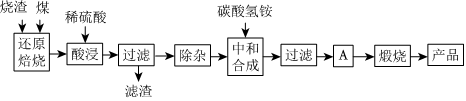
(1)在“還原焙燒”中產生的有毒氣體可能有.
(2)“酸浸”時間一般不超過20min,若在空氣中酸浸時間過長,溶液中Fe2+含量將下降,其原因是(用離子方程式表示).
(3)根據下表數據:
在“除雜”步驟中,為除去Fe3+和Al3+,溶液的pH最大值應小于氫氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 開始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,檢驗Fe3+已經除盡的試劑是;當pH=5時,溶液中c(Al3+)=mol?L-1(已知常溫下Ksp[Al(OH)3]=2.0×10-33).
(4)“中和合成”的目的是將溶液中Fe2+轉變為碳酸亞鐵沉淀,則A的操作是.
(5)a g燒渣經過上述工藝可得紅氧化鐵b g.藥典標準規定,制得的紅氧化鐵中含氧化鐵不得少于98.0%,則所選用的燒渣中鐵的質量分數應不低于(用含a、b的表達式表示).發布:2025/1/19 8:0:1組卷:114引用:4難度:0.5 -
3.硫鐵礦燒渣是硫鐵礦生產硫酸過程中產生的工業廢渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等雜質).用該燒渣制取藥用輔料--紅氧化鐵的工藝流程如下:
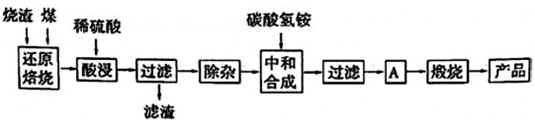
(1)在“還原焙燒”中產生的有毒氣體可能有.
(2)“酸浸”時間一般不超過20min,若在空氣中酸浸時間過長,溶液中Fe2+含量將下降,其原因是(用離子方程式表示).
(3)根據下表數據:
在“除雜”步驟中,為除去Fe3+和Al3+,溶液的pH最大值應小于氫氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 開始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,常溫下,當pH=5時,溶液中c(Al3+)=mol?L-1(已知常溫下Ksp[Al(OH)3]═2.0×10-33).
(4)“中和合成”的目的是將溶液中Fe2+轉變為碳酸亞鐵沉淀,則A的操作是.發布:2025/1/19 8:0:1組卷:12引用:1難度:0.5


