生活中常見的化合物:海洋是人類寶貴的自然資源,海水“曬鹽”和海水“制堿”體現了人類利用改造自然的智慧
(一)海水制鹽。
(1)寫出食鹽的一種用途:調味品或生理鹽水或制取碳酸鈉等調味品或生理鹽水或制取碳酸鈉等。
(2)從海水制取的粗鹽中含有泥沙、硫酸鎂和氯化鈣等雜質,為得到較純的氯化鈉,將粗鹽溶于水,然后進行如下操作:a.加過量的 Ba(OH)2溶液;b.加稍過量的鹽酸;c.加過量的 Na2CO3溶液;d.過濾;e.蒸發;正確的操作順序是(填字母) acdbeacdbe。加 Na2CO3溶液的作用是除去 氯化鈣和過量的氫氧化鋇氯化鈣和過量的氫氧化鋇。
(二)海水“制堿”
我國著名化學家侯德榜發明的聯合制堿法的主要過程是:先向飽和食鹽水中通入氨氣,再通入二氧化碳,通過化學反應生成NaHCO3和NH4Cl,NaHCO3結晶析出。化學反應原理為:NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl;
②將析出的碳酸氫鈉加熱制得純堿碳酸鈉。
(3)寫出②反應的化學方程式 2NaHCO3 △ Na2CO3+CO2↑+H2O2NaHCO3 △ Na2CO3+CO2↑+H2O。
某化學小組根據已經掌握的化學知識設計了如圖實驗,
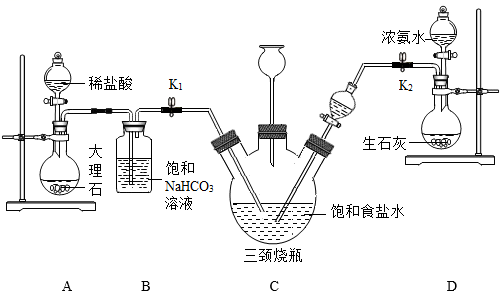
化學興趣小組在實驗室模擬聯合制堿法進行了如下實驗:
Ⅰ、關閉 K1,先打開 K2通入 NH3,調節氣流速率,待其穩定后,再打開 K1通入 CO2。
Ⅱ、待三頸燒瓶內出現較多固體時,關閉 K2停止通入 NH3;一段時間后關閉K1停止通入 CO2。
Ⅲ、將三頸燒瓶內反應后的混合物過濾,將濾出的固體洗滌、低溫干燥,得到碳酸氫鈉固體。再將其加熱使其完全分解即得純堿。
請回答下列問題。
(4)B 裝置中飽和碳酸氫鈉溶液的作用是 除去二氧化碳中的氯化氫除去二氧化碳中的氯化氫。
(5)D 裝置中生石灰的作用是 氧化鈣和水反應放熱使氨氣快速放出氧化鈣和水反應放熱使氨氣快速放出。
(6)C 裝置中長頸漏斗的作用除了隨時添加飽和食鹽水,還有 平衡氣壓平衡氣壓作用。
(7)有同學認為應該在長頸漏斗內放置浸有稀硫酸的棉花團,其目的是 吸收氨氣,防止污染空氣吸收氨氣,防止污染空氣關閉K2停止通入NH3,還要繼續通入一段時間CO2,其目的是 盡可能多的通入CO2,提高碳酸氫鈉的產率盡可能多的通入CO2,提高碳酸氫鈉的產率;寫出副產品氯化銨和熟石灰反應的化學方程式 Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2OCa(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O。
△
△
【答案】調味品或生理鹽水或制取碳酸鈉等;acdbe;氯化鈣和過量的氫氧化鋇;2NaHCO3 Na2CO3+CO2↑+H2O;除去二氧化碳中的氯化氫;氧化鈣和水反應放熱使氨氣快速放出;平衡氣壓;吸收氨氣,防止污染空氣;盡可能多的通入CO2,提高碳酸氫鈉的產率;Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O
△
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:49引用:1難度:0.5
相似題
-
1.我國的領海主權不容侵犯,南海是我國的固有領海,蘊藏著豐富的海洋資源。
(1)南海不僅蘊含著大量的煤、石油、天然氣等常規能源,還蘊藏著大量的可燃冰。可燃冰(主要成分是CH4)被科學家譽為“未來能源”,CH4燃燒的化學方程式,可燃冰作為能源與煤、石油相比的優點是。
(2)南海某島采用風力發電提供的電能對海水進行了如圖1所示的綜合利用。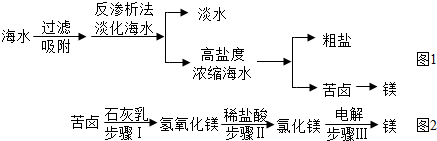
①反滲析法淡化海水是利用海水中各成分的不同分離出淡水。
②將高鹽度濃縮海水進行可以分離得到粗鹽。
③用苦鹵制取金屬鎂的流程圖如圖2:
上述轉化過程中,所發生的反應屬于復分解反應類型的步驟是(填序號),步驟Ⅱ的化學方程式為。利用苦鹵制取氫氧化鎂比“直接向海水中加入石灰乳制取氫氧化鎂”的優勢是。
(3)如圖3是海水“制堿”的部分簡單流程。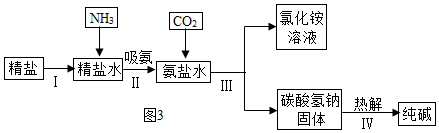
①步驟IⅡ反應的化學方程式為;
②制氨鹽水的過程中要先通入氨氣,再通入二氧化碳,如果反過來,二氧化碳的吸收率會降低,這是因為;
③氨鹽水吸收二氧化碳后生成碳酸氫鈉和氯化銨,首先析出的物質是,原因是,將氯化銨溶液和碳酸氫鈉固體分離的方法是過濾,濾液中的溶質有。發布:2024/12/25 12:0:1組卷:85引用:4難度:0.6 -
2.海洋是人類巨大的資源寶庫,其中含有的可溶性物質包括MgCl2等。如圖為從海水中提取金屬鎂的簡易流程圖。

(1)海洋中含量最多的物質是。
(2)貝殼煅燒的化學方程式是。
(3)操作Ⅰ的名稱是,進行該操作時,用到的玻璃儀器有燒杯、玻璃棒和。其中玻璃棒的作用是。
(4)生石灰轉化為石灰乳的過程是反應(選填“吸熱”或“放熱”)。
(5)寫出氫氧化鎂和鹽酸反應的化學方程式。
(6)上述流程中未涉及到的基本反應類型是反應。發布:2024/12/24 12:0:2組卷:220引用:4難度:0.2 -
3.閩東的淡水和海水資源豐富
(1)興趣小組測量集中水樣的pH,得到下表數據,其中堿性最強的是(填序號)
(2)山泉水含有較多鈣、鎂離子,硬度較高水樣 來源 pH A 泉水:“海上仙都”-太姥山 6.8~7.0 B 河水:“海國桃園”-楊家溪 7.2~7.6 C 海水:“天然良港”-三都澳 7.8~8.0
①寫出鈣離子的符號
②若要降低其硬度,可采用的方法是(寫一種)
(3)海水是重要資源,處理的大致流程如圖: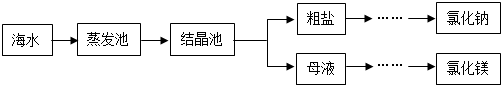
①粗鹽經過溶解、過濾、蒸發可除去海沙等不溶性雜質.
a.海沙的主要成分是二氧化硅(SiO2),其中Si的化合價為.
b.若以上操作在實驗室中進行,溶解時,玻璃棒的作用是.
②母液經過處理,可得氯化鎂,點解熔融氯化鎂生成鎂和氯氣(Cl2).寫出電解氯化鎂的化學方程式:.發布:2024/12/22 8:0:1組卷:13引用:1難度:0.5


