某化學興趣小組采用如圖所示裝置研究NaHCO3分解產物CO2與Na2O2反應。

完成下列填空:
(1)畫出乙中實驗裝置圖,并標出相應試劑: ,試劑為濃硫酸
,試劑為濃硫酸 ,試劑為濃硫酸。
,試劑為濃硫酸。
(2)實驗開始后,裝置丙中反應的化學方程式:2CO2+2Na2O2=2Na2CO3+O22CO2+2Na2O2=2Na2CO3+O2,該反應中氧化劑與還原劑的質量比為 1:11:1。
(3)裝置丁中NaOH溶液的作用是 吸收未反應的CO2吸收未反應的CO2,裝置戊中澄清石灰水的作用是 證明CO2已經完全被吸收證明CO2已經完全被吸收。
(4)NaHCO3俗稱小蘇打,工業上可通過侯氏制堿法制取(又稱聯合制堿法,由我國近代著名的化工學家侯德榜發明),即用食鹽、氨氣、二氧化碳、水為原料制取。寫出侯氏制堿法中生成NaHCO3的離子方程式:Na++NH3+CO2+H2O=NaHCO3↓+NH+4Na++NH3+CO2+H2O=NaHCO3↓+NH+4。操作時,往飽和食鹽水中先通入氨氣再通入二氧化碳,原因是 氨氣在食鹽水中溶解度更大,形成氨水溶液,使通入CO2與氨水反應,從而可以溶解更多的CO2氨氣在食鹽水中溶解度更大,形成氨水溶液,使通入CO2與氨水反應,從而可以溶解更多的CO2。
 ,試劑為濃硫酸
,試劑為濃硫酸 ,試劑為濃硫酸
,試劑為濃硫酸NH
+
4
NH
+
4
【考點】性質實驗方案的設計;純堿工業(侯氏制堿法).
【答案】 ,試劑為濃硫酸;2CO2+2Na2O2=2Na2CO3+O2;1:1;吸收未反應的CO2;證明CO2已經完全被吸收;Na++NH3+CO2+H2O=NaHCO3↓+;氨氣在食鹽水中溶解度更大,形成氨水溶液,使通入CO2與氨水反應,從而可以溶解更多的CO2
,試劑為濃硫酸;2CO2+2Na2O2=2Na2CO3+O2;1:1;吸收未反應的CO2;證明CO2已經完全被吸收;Na++NH3+CO2+H2O=NaHCO3↓+;氨氣在食鹽水中溶解度更大,形成氨水溶液,使通入CO2與氨水反應,從而可以溶解更多的CO2
 ,試劑為濃硫酸;2CO2+2Na2O2=2Na2CO3+O2;1:1;吸收未反應的CO2;證明CO2已經完全被吸收;Na++NH3+CO2+H2O=NaHCO3↓+
,試劑為濃硫酸;2CO2+2Na2O2=2Na2CO3+O2;1:1;吸收未反應的CO2;證明CO2已經完全被吸收;Na++NH3+CO2+H2O=NaHCO3↓+NH
+
4
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:53引用:1難度:0.3
相似題
-
1.如圖是在實驗室進行二氧化硫制備與性質實驗的組合裝置,部分固定裝置未畫出。
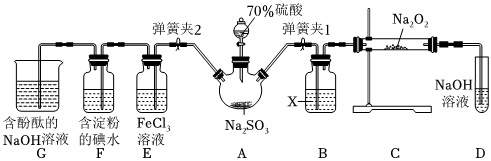
(1)在組裝好裝置后,若要檢驗A~D裝置的氣密性,其操作是首先,然后往D中裝入水,然后微熱A,觀察到D中有氣泡冒出,移開酒精燈或松開雙手,D中導管有水柱形成且高度保持不變,說明裝置氣密性良好。
(2)裝置D中盛放NaOH溶液的作用是。
(3)關閉彈簧夾1后,打開彈簧夾2,殘余氣體進入E、F、G中,能說明I-還原性弱于SO2的現象為;發生反應的離子方程式是。
(4)為了驗證E中SO2與FeCl3發生了氧化還原反應,設計了如下實驗:取E中的溶液,往溶液中加入用稀硝酸酸化的BaCl2溶液,產生白色沉淀,說明SO2與FeCl3發生了氧化還原反應。上述方案是否合理?(填“合理”或“不合理”),原因是。
(5)實驗過程中G中含酚酞的NaOH溶液逐漸褪色,此實驗證明SO2具有漂白性還是其溶于水顯酸性?請設計實驗驗證:。發布:2024/12/30 14:0:1組卷:29引用:2難度:0.5 -
2.某化學興趣小組為探究銅跟濃硫酸的反應,用圖裝置進行有關實驗.請回答下列問題:
(1)裝置A中發生的化學反應的化學方程式為.
(2)裝置B 的作用是貯存多余的氣體,B中廣口瓶內應盛放的液體是(填序號)
①水 ②酸性KMnO4 ③Na2CO3溶液 ④飽和的NaHSO3溶液
(3)裝置C和D 中產生的現象相同,但原因卻不同.用離子方程式和必要的文字解釋C中溶液褪色的原因
(4)裝置D中試管口塞一團棉花,棉花中應浸有一種液體,這種液體是.
(5)實驗完畢,待A中燒瓶內液體冷卻后,過濾,向濾液中加入少量的蒸餾水稀釋,溶液為藍色.為了證明藍色只與Cu2+有關,而與其它離子無關,某同學設計了下列實驗,其中對實驗目的沒有意義的是(填序號)
①觀察稀H2SO4 溶液呈無色 ②觀察CuSO4 粉末呈白色 ③稀釋CuSO4溶液,溶液藍色變淺 ④往CuSO4溶液中加入足量NaOH溶液,生成藍色沉淀,過濾,濾液呈無色⑤往CuSO4溶液中加入足量BaCl2的溶液,生成白色沉淀,過濾,濾液仍顯藍色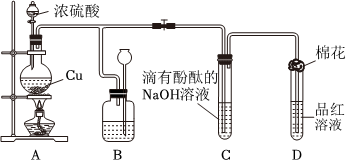 發布:2024/12/30 14:30:1組卷:13引用:2難度:0.7
發布:2024/12/30 14:30:1組卷:13引用:2難度:0.7 -
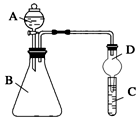 3.某同學為探究元素周期表中元素性質的遞變規律,設計了如下系列實驗。
3.某同學為探究元素周期表中元素性質的遞變規律,設計了如下系列實驗。
Ⅰ.(1)將鈉、鉀、鎂、鋁各1mol分別投入到足量的同濃度的鹽酸中,試預測實驗結果:與鹽酸反應最劇烈,與鹽酸反應產生的氣體最多。(填元素符號)
(2)向Na2S溶液中通入氯氣出現黃色渾濁,可證明Cl的非金屬性比S強,反應的離子方程式為:。
Ⅱ.利用如圖裝置可驗證同主族元素非金屬性的變化規律
(1)儀器A的名稱為。
(2)實驗室中現有藥品:①稀鹽酸 ②稀硝酸 ③Na2SiO3溶液 ④Na2CO3固體,請選擇合適藥品設計實驗驗證 N、C、Si的非金屬性的變化規律;裝置A、B中所裝藥品分別為、。(填序號)但有同學認為該裝置有缺陷,如何改進?。發布:2024/12/30 14:30:1組卷:19引用:2難度:0.5


