將體積為V1質量分數為3.65%的HCl溶液逐滴滴入盛有體積為V2未知濃度的NaOH溶液的燒杯中(如圖1),測量并記錄溶液的pH變化(如圖2)和溫度變化(如圖3)。(實驗中始終保持V1+V2=50.0mL且各種溶液密度均為1.0g/mL)

(1)圖2中V1=0時,圖1中燒杯內溶液的顏色顯 紅紅色。
(2)實驗中發生反應的化學方程式為 HCl+NaOH=NaCl+H2OHCl+NaOH=NaCl+H2O。
(3)圖2中的pH=7時,此時滴入的HCl溶液的體積V1=3030mL。
(4)通過該實驗給出的判斷,其中正確的是 BB。
A.進行該實驗時環境溫度為22℃
B.該實驗中的反應放出熱量
C.該實驗表明有水生成的反應都是放熱反應
D.溶液由堿性轉變為中性,再轉變為酸性且酸性不斷減弱
【答案】紅;HCl+NaOH=NaCl+H2O;30;B
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:32引用:2難度:0.5
相似題
-
1.電導率是衡量溶液導電能力大小的物理量,在相同條件下,電導率與離子濃度(單位體積內的離子數)成正比,鹽酸和氫氧化鈉反應電導率曲線如圖所示,以下分析不正確的是( )
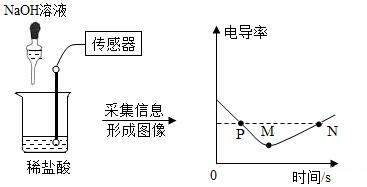
A.電導率減小可能是由于溶液中離子數量逐漸減小 B.M點時NaOH溶液與稀鹽酸恰好完全反應 C.N點時溶液中的離子數大于P點 D.該實驗證明溶液中始終含有帶電的粒子 發布:2024/12/28 15:30:1組卷:78引用:6難度:0.5 -
2.向盛有50g 10% Ba(OH)2溶液的燒杯中慢慢滴加稀硫酸至過量,如圖(縱坐標表示燒杯中其他量的變化)所有有關量的變化與所加入稀硫酸質量的關系錯誤的是( )
A. 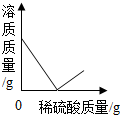
B. 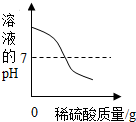
C. 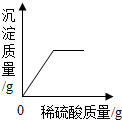
D.  發布:2024/12/28 15:30:1組卷:15引用:4難度:0.5
發布:2024/12/28 15:30:1組卷:15引用:4難度:0.5 -
3.等質量的氫氧化鈉溶液和稀鹽酸混合后,若所得溶液pH=7,則( )
A.所用氫氧化鈉溶液和稀鹽酸的溶質質量分數相等 B.混合溶液中鈉離子與氯離子個數相等 C.混合前后水分子總數不變 D.混合前后陽離子總數不變 發布:2024/12/28 15:0:1組卷:134引用:10難度:0.5


